A utilização da cannabis medicinal em pacientes pediátricos tem se tornado um tema de crescente interesse e debate na prática clínica contemporânea. À medida que observamos a expansão das evidências científicas e a progressiva aceitação regulatória em diversos países, torna-se essencial que o médico esteja apto a compreender com profundidade as complexas nuances farmacológicas, os perfis de segurança e as implicações éticas associadas a essa forma terapêutica em crianças e adolescentes.
Entendendo o Sistema Endocanabinoide infantil
O sistema endocanabinoide (SEC) é uma complexa rede de sinalização envolvida na regulação de funções fisiológicas e neurológicas desde os primeiros estágios da vida. Formado por receptores canabinoides acoplados à proteína G (GPCRs), como o CB1R e o CB2R, além de seus ligantes endógenos — a anandamida (AEA) e o 2-araquidonoilglicerol (2-AG) — e das enzimas que controlam sua síntese e degradação, esse sistema apresenta uma dinâmica singular de atividade ao longo do desenvolvimento.
Compreender como o SEC funciona na infância é essencial, especialmente porque sua expressão e função se alteram de forma marcante durante a ontogênese. Essas mudanças não são aleatórias — elas refletem processos altamente orquestrados que contribuem para a formação e o amadurecimento do organismo.
Desde a vida intrauterina, o SEC mostra um padrão de distribuição que varia conforme a região cerebral e a fase do desenvolvimento. Por exemplo, em cérebros fetais, observa-se uma alta densidade de receptores CB1R, especialmente nos gânglios da base — com destaque para o globo pálido interno —, apresentando uma concentração mais que o dobro daquela encontrada no período neonatal.¹
Com o nascimento, essa distribuição começa a se reorganizar. Estruturas como o mesencéfalo — incluindo a substância negra pars reticulata, o núcleo vermelho e o colículo superior — passam a apresentar níveis elevados de CB1R nos neonatos, níveis estes que são mais expressivos do que os encontrados em adultos. Esse padrão demonstra que há uma expressão transitória e específica desses receptores em determinadas fases do desenvolvimento, provavelmente relacionada a processos críticos como a neurogênese e o estabelecimento de redes sinápticas funcionais.¹
Quando analisamos os ligantes endógenos, notamos que o 2-AG predomina nas fases iniciais da vida. Seus níveis são significativamente mais altos no cérebro fetal e no período perinatal, podendo chegar a ser o dobro dos observados em outras idades. Essa abundância parece estar diretamente relacionada à intensa atividade neuroplástica desse período.¹
A síntese do 2-AG ocorre principalmente por meio das isoformas da lipase diacilglicerol (DAGL-α e DAGL-β), enquanto sua degradação envolve a lipase monoacilglicerol (MAGL) e as serina hidrolases ABHD6 e ABHD12. Ao longo da infância e adolescência, observa-se uma modulação expressiva dessas enzimas. Por exemplo, a DAGL-β é fortemente expressa no início da vida, mas rapidamente decresce no período pós-natal.¹
Em contraste, a DAGL-α tem sua expressão ampliada na adolescência e início da vida adulta, enquanto os níveis de MAGL são mais elevados na infância. Já a ABHD6, envolvida na degradação do 2-AG, mostra aumento progressivo com a idade, indicando uma transição gradual na forma como o sistema regula esse tônus endocanabinoide.¹
A anandamida (AEA), por sua vez, apresenta uma trajetória diferente. Seus níveis são inicialmente baixos no cérebro fetal, mas aumentam de forma progressiva ao longo da infância, atingindo um pico na adolescência e retornando a níveis mais baixos na idade adulta. Sua produção é mediada principalmente pela N-acil fosfatidiletanolamina fosfolipase D (NAPE-PLD), enquanto sua degradação ocorre pela amida hidrolase de ácidos graxos (FAAH). Interessantemente, a atividade da FAAH durante a adolescência parece se correlacionar inversamente aos níveis de AEA, sugerindo um papel fundamental dessa fase no ajuste fino do tônus endocanabinoide.¹
Outro aspecto importante é a maturação dos receptores CB1R. Sua expressão atinge o ápice nos primeiros anos de vida, com maior concentração no estriado e no córtex pré-frontal — regiões chave para o desenvolvimento das funções cognitivas e emocionais. Com o avançar da idade, essa expressão se estabiliza, mas tende a declinar na senescência, especialmente em áreas límbicas e associativas, como o córtex pré-frontal medial. A redução ocorre de forma mais tardia em regiões sensório-motoras.¹
Essas variações ao longo do tempo não são meramente quantitativas. Elas acompanham transformações estruturais e funcionais no cérebro, como a consolidação sináptica e a maturação das vias de neurotransmissão. Assim, o SEC se revela como um modulador essencial não apenas da atividade neuronal, mas também da arquitetura cerebral em formação.¹
A compreensão do sistema endocanabinoide na infância nos permite enxergar o cérebro em desenvolvimento sob uma nova perspectiva — dinâmica, adaptativa e altamente sensível às demandas do ambiente interno e externo. A presença robusta de receptores, ligantes e enzimas nas fases iniciais da vida aponta para um papel essencial do SEC na formação das bases neurobiológicas que sustentam a cognição, a emoção e o comportamento ao longo da vida.
Por isso, ao pensar em estratégias terapêuticas que envolvam a modulação do SEC em pediatria, é crucial considerar não apenas a segurança farmacológica, mas também o momento do desenvolvimento em que essa intervenção ocorre.
Evidências científicas em indicações pediátricas
Epilepsia Refratária
Para as famílias de crianças com epilepsia refratária, cada convulsão representa um universo de apreensão e impotência. Muitas crianças epilépticas continuam a apresentar crises convulsivas mesmo após tratamento com múltiplos medicamentos anticonvulsivantes. Nesse cenário, novas alternativas terapêuticas são recebidas com uma combinação de esperança e cautela.
Entre as alternativas terapêuticas disponíveis, o canabidiol (CBD) destaca-se como um dos principais agentes no uso medicinal da cannabis atualmente. Ensaios clínicos rigorosos têm demonstrado de forma consistente que o CBD é capaz de reduzir significativamente a frequência das crises epilépticas, especialmente em síndromes graves como Dravet e Lennox-Gastaut. Os dados são expressivos: observam-se reduções médias de 36% a 49% na ocorrência das crises, promovendo uma mudança profunda na qualidade de vida das crianças afetadas e de suas famílias.²
Para saber mais sobre o uso de Canabidiol no tratamento da Epilepsia Refratária acesse: Canabidiol no tratamento da Epilepsia Refratária – WeCann Academy
Embora os principais ensaios clínicos tenham utilizado CBD farmacêutico purificado (como Epidiolex®), evidências observacionais sugerem que extratos da planta enriquecidos em CBD — contendo pequenas quantidades de tetraidrocanabinol (THC) e outros fitocanabinoides — podem apresentar eficácia em doses mais baixas e com perfis de efeitos adversos distintos.³
Essa hipótese se apoia no conceito do “efeito entourage”, segundo o qual os compostos da cannabis atuam de forma sinérgica, potencializando seus efeitos terapêuticos. Nesse sentido, formulações com proporções de CBD para THC de 50:1, 25:1 ou 20:1 têm mostrado resultados promissores, inclusive em síndromes particularmente desafiadoras, como a síndrome de West.4
O CBD modula a excitabilidade neuronal por meio de múltiplos mecanismos, entre eles a regulação de canais iônicos, o aumento da disponibilidade de anandamida e a interação com receptores neurais não canabinoides. Essa atuação multifacetada pode explicar a eficácia do CBD em pacientes refratários a medicamentos tradicionais, que em geral atuam em vias específicas.5
Para saber mais sobre como a Cannabis atua na Excitabilidade Neural acesse: Efeitos da Cannabis na Excitabilidade Cerebral – WeCann Academy
Transtorno do Espectro Autista:
O autismo é uma condição de natureza complexa, caracterizada por dificuldades na comunicação social, padrões de comportamento restritos e interesses repetitivos. Recentemente, descobertas sobre o sistema endocanabinoide trouxeram novas peças a esse quebra-cabeça: níveis reduzidos de anandamida e outros endocanabinoides foram identificados em crianças com TEA, sugerindo uma possível disfunção em mecanismos essenciais à comunicação neural.6
Estudos pré-clínicos trouxeram sinais promissores: modelos animais com fenótipo semelhante ao TEA tratados com CBD demonstraram melhora nos comportamentos sociais e redução da ansiedade. Até mesmo misturas específicas de terpenos — compostos aromáticos da cannabis — mostraram benefícios comportamentais, reforçando a importância da complexidade fitoquímica da planta.7
Com o tempo, famílias e médicos passaram a documentar suas experiências de forma mais estruturada. Em um estudo retrospectivo envolvendo 21 crianças com TEA tratadas com extratos de cannabis por pelo menos três meses, observou-se melhora em domínios como dificuldades sensoriais, qualidade do sono e controle das crises associadas.8
As formulações ricas em CBD, com pequenas quantidades de THC (20:1), mostraram-se particularmente eficazes, promovendo melhorias na interação social, comunicação e comportamento.9 Curiosamente, em alguns casos, a elevação da razão CBD:THC para 75:1 pareceu amplificar ainda mais os benefícios, especialmente em crianças com comorbidades como distúrbios do sono e TDAH.10
Para saber mais sobre o uso da cannabis no tratamento do TEA acesse: Cannabis no tratamento do Transtorno do Espectro Autista (TEA): Uma alternativa promissora
Além disso, um estudo randomizado e controlado por placebo em TEA trouxe uma revelação interessante: apenas a formulação contendo CBD e THC em proporção de 20:1 superou o placebo em melhorias de comportamento disruptivo e responsividade social. Nem o CBD isolado, nem o THC isolado, produziram tais efeitos.11
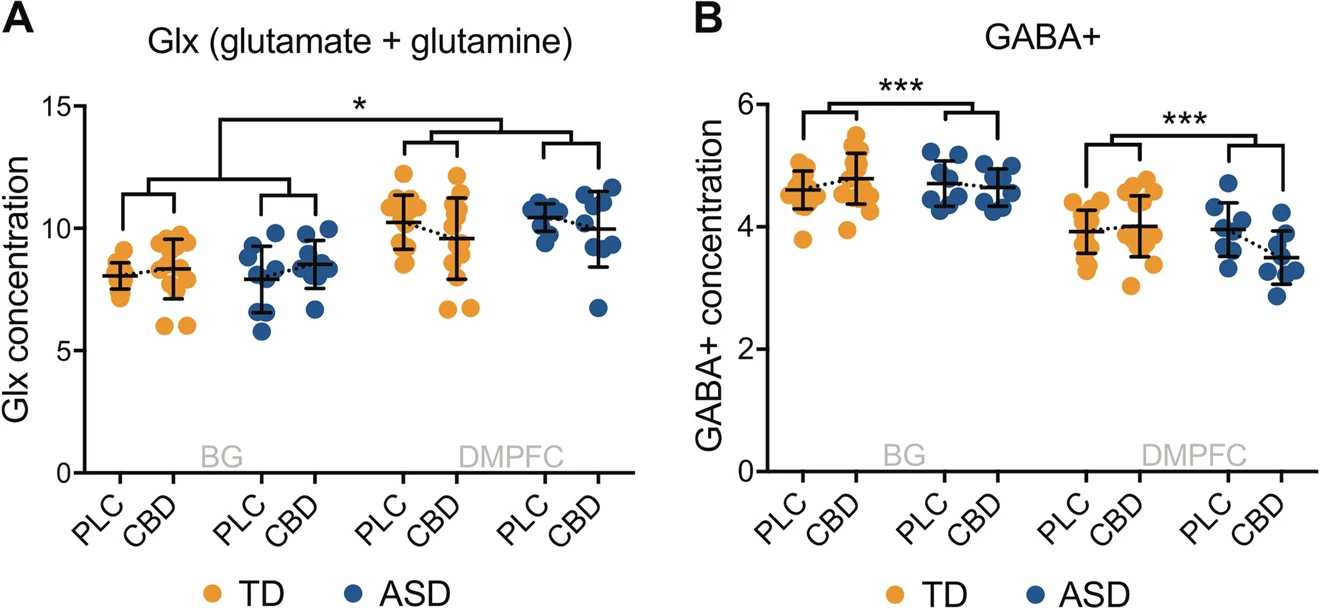
Esses resultados reforçam a hipótese do “efeito entourage” e indicam que, para crianças com TEA, abordagens combinadas podem ser superiores aos compostos isolados. Adicionalmente, estudos de neuroimagem começam a desvendar alterações induzidas pelo CBD em sistemas neurotransmissores como o glutamato e o GABA — elementos centrais para o equilíbrio da atividade cerebral, frequentemente disfuncionais no autismo.12
TDAH
O TDAH, caracterizado por desatenção, impulsividade e hiperatividade, envolve disfunções nos circuitos dopaminérgicos responsáveis pelo controle executivo e regulação emocional. Dado que o sistema endocanabinoide também modula a neurotransmissão dopaminérgica, abre-se uma hipótese interessante para o uso de canabinoides como ferramenta terapêutica.
Modelos animais e estudos preliminares sugerem alterações na expressão de receptores CB1 e no metabolismo de anandamida em pacientes com TDAH, reforçando essa conexão teórica.7 Entretanto, ao contrário do que ocorre em epilepsia e TEA, as evidências para o uso de canabinoides no TDAH pediátrico ainda são escassas. A maior parte dos dados disponíveis provém de estudos em adultos.
Em adultos, relatos indicam que formulações com CBD e THC podem reduzir sintomas de impulsividade e hiperatividade, além de melhorar a regulação emocional. Um ensaio piloto com Sativex® (THC:CBD 1:1) demonstrou redução da impulsividade e hiperatividade, sem impacto negativo no desempenho cognitivo.13
Para saber mais sobre o uso da cannabis no tratamento do TDAH acesse: Cannabis no tratamento do TDAH: Uma alternativa promissora
Espasticidade e outras condições clínicas
A espasticidade infantil, frequentemente associada a condições como a paralisia cerebral, representa um desafio terapêutico significativo. Caracterizada por rigidez muscular, dor e comprometimento funcional, essa condição impacta profundamente a qualidade de vida das crianças e de suas famílias.
Evidências emergentes sugerem que a cannabis medicinal, especialmente em formulações combinando CBD e THC em proporções balanceadas, pode oferecer uma alternativa eficaz no manejo da espasticidade refratária. Ensaios clínicos conduzidos em adultos com esclerose múltipla — condição na qual a espasticidade é um sintoma predominante — já demonstraram benefícios consistentes, e estudos observacionais começam a indicar efeitos semelhantes em populações pediátricas.14
Um estudo aberto envolvendo 25 crianças, de 1 a 17 anos, com distúrbios motores complexos, demonstrou melhora significativa em parâmetros como espasticidade, distonia, qualidade do sono, gravidade da dor e qualidade de vida. As crianças receberam durante cinco meses extratos artesanais de cannabis ricos em CBD, em duas proporções diferentes: CBD:THC de 20:1 ou de 6:1. Não foram observadas diferenças significativas de eficácia entre as formulações.15
Além disso, duas séries de casos reforçam essas observações: uma envolvendo 12 crianças com espasticidade refratária associada a distúrbios do desenvolvimento e outra com 7 crianças com neurodegeneração associada à deficiência de pantotenato quinase (PKAN). Em ambos os relatos, observou-se melhora em graus variados da espasticidade e da distonia após o tratamento com dronabinol (forma sintética de THC) ou com diferentes extratos de cannabis.16,17
O uso da cannabis medicinal na prática pediátrica também vem sendo explorado para outras indicações, incluindo dor neuropática, distúrbios do sono, náuseas associadas à quimioterapia e sintomas neuropsiquiátricos resistentes. Relatos de casos descreveram benefícios em crianças com dor neuropática e transtorno depressivo maior comórbido tratadas com dronabinol (n = 2), em um caso de transtorno de estresse pós-traumático (TEPT) tratado com CBD (n = 1) e em uma criança com síndrome de Tourette tratada com THC (n = 1).18
Apesar dos resultados promissores, é fundamental destacar que o uso pediátrico da cannabis medicinal requer protocolos rigorosos, supervisão médica constante e avaliação individualizada de riscos e benefícios. Nesse contexto, estudos abertos de maior escala e ensaios clínicos randomizados controlados são necessários para consolidar a segurança e eficácia dessas abordagens terapêuticas em crianças.
Segurança do uso medicinal na população pediátrica
A utilização de cannabis medicinal em pediatria representa uma fronteira terapêutica promissora, porém cercada de considerações fundamentais quanto à segurança. As evidências científicas atuais demonstram uma distinção entre preparações com predominância de CBD e aquelas contendo THC. O CBD tem demonstrado um perfil de segurança mais favorável, particularmente no tratamento de síndromes epilépticas refratárias como a Síndrome de Dravet, tendo inclusive recebido aprovação do FDA em 2018 especificamente para esta indicação na população pediátrica.19
Entretanto, é importante salientar que os dados de segurança não podem ser generalizados indiscriminadamente para todas as condições clínicas. As análises combinadas de estudos clínicos randomizados sugerem que o CBD provavelmente resulta em uma redução significativa (aproximadamente 50%) no risco de eventos convulsivos em crianças com epilepsia, além de melhorar a impressão global de mudança clínica (CGIC).19
Vale ressaltar que a maioria dos estudos que fundamentam as análises de segurança apresenta períodos de acompanhamento relativamente curtos, variando entre 3 e 18 semanas. Esta limitação temporal constitui um desafio significativo para compreensão dos efeitos a longo prazo, especialmente considerando-se a sensibilidade do sistema nervoso central em desenvolvimento.19
Efeitos colaterais documentados
Os efeitos colaterais associados à terapia com canabinoides em crianças merecem atenção detalhada por parte dos prescritores. As meta-análises recentes identificaram padrões consistentes de eventos adversos, com destaque para diminuição do apetite, particularmente acentuada com doses elevadas de CBD (20 mg/kg/dia).19
Outro aspecto relevante concerne aos eventos mentais adversos (alterações de humor, sonolência e sedação, letargia e fadiga), observados com diferentes formulações de canabinoides, independentemente da composição específica (CBD, THC ou formulações mistas) ou indicação terapêutica. A incidência desses eventos mentais adversos parece ser mais pronunciada em estudos envolvendo nabilona comparativamente àqueles que utilizam produtos mistos de THC-CBD ou CBD isolado.19
Adicionalmente, os dados sugerem um potencial aumento do risco de eventos adversos gastrointestinais, incluindo hiperatividade gastrointestinal, bem como possível elevação na incidência de pirexia com uso de CBD, embora estes últimos dados permaneçam inconclusivos e demandem investigações adicionais.19
Particularmente preocupante é a possibilidade de Eventos Adversos Graves (EAG), com meta-análises sugerindo uma elevação não significativa de 1,63 vezes no risco. A ausência de significância estatística pode derivar de poder estatístico insuficiente, conforme indicado por análises sequenciais, entretanto, este sinal de segurança deve ser considerado com seriedade, especialmente na farmacoterapia pediátrica.
Considerações na prescrição
A prescrição de derivados canabinoides na população pediátrica envolve complexas considerações éticas que transcendem a simples análise de eficácia. O balanço entre benefícios documentados e riscos potenciais deve ser cuidadosamente avaliado e comunicado às famílias com transparência.
Um aspecto frequentemente negligenciado, porém fundamental, refere-se às particularidades do sistema endocanabinoide em crianças e adolescentes. Esta singularidade fisiológica suscita preocupações legítimas quanto à modulação exógena do sistema endocanabinoide durante fases críticas do desenvolvimento neurológico.
A ausência de dados sobre os efeitos a longo prazo do uso de cannabis medicinal em crianças representa um desafio ético adicional, uma vez que ainda não foram conduzidos estudos controlados de longa duração nessa população.
Diante dessa lacuna de conhecimento, é fundamental que os profissionais de saúde comuniquem claramente essas limitações científicas às famílias, promovendo um processo de decisão compartilhada, baseado nas melhores evidências disponíveis. A escolha pela terapia com cannabis medicinal deve sempre considerar, de forma individualizada, a análise cuidadosa dos riscos e benefícios envolvidos.
Estratégias para minimização de riscos
Diante do panorama apresentado, estratégias robustas para minimização de riscos tornam-se imprescindíveis quando da utilização de derivados canabinoides em crianças. O monitoramento nutricional assume caráter prioritário, considerando-se o potencial de diminuição do apetite, particularmente relevante em crianças com epilepsia ou transtorno do espectro autista, que frequentemente já apresentam comprometimento do crescimento e dificuldades alimentares.
A vigilância sistemática de eventos mentais adversos, independentemente da formulação utilizada, deve constituir prática regular durante o acompanhamento clínico. Esta monitorização deve estender-se ao desenvolvimento físico e neurológico global, buscando identificar precocemente quaisquer desvios potencialmente associados à terapêutica.
A titulação cuidadosa da dosagem representa estratégia fundamental na minimização de riscos, considerando-se as evidências de Network Meta-Analysis que demonstram diferenças significativas na incidência de efeitos adversos entre diferentes regimes posológicos. Neste contexto, preconiza-se a utilização da menor dose eficaz possível, com incrementos graduais conforme necessidade clínica e tolerabilidade individual.19
Por fim, a abordagem multidisciplinar, médicos, nutricionistas e psicólogos, entre outros especialistas, potencializa a detecção precoce e manejo adequado de possíveis eventos adversos, otimizando a relação risco-benefício desta modalidade terapêutica.
Conclusão
O uso da cannabis medicinal em crianças deve ser pautado em rigorosa avaliação científica e ética, considerando o momento específico do desenvolvimento neurológico e o perfil individual de cada paciente. O conhecimento aprofundado sobre o sistema endocanabinoide infantil e a interpretação criteriosa das evidências disponíveis são fundamentais para garantir intervenções seguras, eficazes e responsáveis.
Diante dos avanços no entendimento da farmacologia dos canabinoides e das evidências promissoras em condições como epilepsia refratária e transtorno do espectro autista, a cannabis medicinal surge como uma ferramenta terapêutica relevante na prática pediátrica. Contudo, sua utilização deve sempre ser acompanhada por profissionais qualificados, atentos à complexidade do cérebro em desenvolvimento e aos princípios da medicina baseada em evidências.
ELEVE SUA PRÁTICA CLÍNICA A UM NOVO PATAMAR
Após explorar o potencial da cannabis medicinal no manejo de condições clínicas pediátricas, convidamos você para dar o próximo passo em sua jornada profissional com o WeCann Summit 2025 – o mais importante evento internacional dedicado à medicina endocanabinoide e inovações terapêuticas na saúde.
O WeCann Summit 2025, que acontecerá nos dias 23, 24 e 25 de outubro no Royal Palm Hall, em Campinas, representa uma oportunidade única para aprofundar seu conhecimento sobre o sistema endocanabinoide, suas aplicações clínicas em diversas condições, e novas e promissoras fronteiras da Medicina, como sistemas de suporte à decisão clínica baseados em Inteligência Artificial.
Este evento reúne experts de quatro continentes, oferecendo:
- Conteúdo técnico altamente qualificado;
- Protocolos práticos para implementação imediata em seu consultório;
- Rede de contatos com especialistas e colegas de +50 especialidades e áreas de atuação.
O WeCann Summit 2025 é mais do que um congresso médico: é o ponto de encontro entre ciência, inovação e prática médica de excelência.
Seu passaporte para novas fronteiras da Medicina está disponível apertando no botão abaixo:
Referências
- Dallabrida, K.G.; de Oliveira Bender, J.M.; Chade, E.S.; Rodrigues, N.; Sampaio, T.B. Endocannabinoid System Changes throughout Life: Implications and Therapeutic Potential for Autism, ADHD, and Alzheimer’s Disease. Brain Sci. 2024, 14, 592. https://doi.org/10.3390/brainsci14060592
- Devinsky O, Marsh E, Friedman D, Thiele E, Laux L, Sullivan J, Miller I, Flamini R, Wilfong A, Filloux F, Wong M, Tilton N, Bruno P, Bluvstein J, Hedlund J, Kamens R, Maclean J, Nangia S, Singhal NS, Wilson CA, Patel A, Cilio MR. Cannabidiol in patients with treatment-resistant epilepsy: an open-label interventional trial. Lancet Neurol. 2016 Mar;15(3):270-8. doi: 10.1016/S1474-4422(15)00379-8. Epub 2015 Dec 24. Erratum in: Lancet Neurol. 2016 Apr;15(4):352. doi: 10.1016/S1474-4422(16)00061-2. PMID: 26724101.
- Pamplona FA, da Silva LR, Coan AC. Potential Clinical Benefits of CBD-Rich Cannabis Extracts Over Purified CBD in Treatment-Resistant Epilepsy: Observational Data Meta-analysis. Front Neurol. 2018 Sep 12;9:759. doi: 10.3389/fneur.2018.00759. Erratum in: Front Neurol. 2019 Jan 10;9:1050. doi: 10.3389/fneur.2018.01050. PMID: 30258398; PMCID: PMC6143706.
- Caraballo R, Valenzuela GR. Cannabidiol-enriched medical cannabis as add-on therapy in children with treatment-resistant West syndrome: A study of eight patients. Seizure 2021;92:238-43. doi: 10.1016/j.seizure.2021.10.002.
- MONTAGNER, Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Aran A, Eylon M, Harel M, Polianski L, Nemirovski A, Tepper S, Schnapp A, Cassuto H, Wattad N, Tam J. Lower circulating endocannabinoid levels in children with autism spectrum disorder. Mol Autism. 2019 Jan 30;10:2. doi: 10.1186/s13229-019-0256-6. PMID: 30728928; PMCID: PMC6354384.
- Dallabrida, K.G.; de Oliveira Bender, J.M.; Chade, E.S.; Rodrigues, N.; Sampaio, T.B. Endocannabinoid System Changes throughout Life: Implications and Therapeutic Potential for Autism, ADHD, and Alzheimer’s Disease. Brain Sci. 2024, 14, 592. https://doi.org/10.3390/brainsci14060592
- Kuester, G.; Vergara, K.; Ahumada, A.; Gazmuri, A.M. Oral cannabis extracts as a promising treatment for the core symptoms of autism spectrum disorder: Preliminary experience in Chilean patients. J. Neurol. Sci. 2017, 381, 932–933.
- Bar-Lev Schleider, L.; Mechoulam, R.; Saban, N.; Meiri, G.; Novack, V. Real life Experience of Medical Cannabis Treatment in Autism: Analysis of Safety and Efficacy. Sci. Rep. 2019, 9, 200.
- Fleury-Teixeira, P.; Caixeta, F.V.; Ramires da Silva, L.C.; Brasil-Neto, J.P.; Malcher-Lopes, R. Effects of CBD-Enriched Cannabis sativa Extract on Autism Spectrum Disorder Symptoms: An Observational Study of 18 Participants Undergoing Compassionate Use. Front. Neurol. 2019, 10, 1145.
- Aran A, Harel M, Cassuto H, et al. Cannabinoid treatment for autism: A proof-of-concept randomized trial. Mol Autism 2021;12(1):6. doi: 10.1186/s13229-021-00420-2.
- Pretzsch, C.M.; Freyberg, J.; Voinescu, B.; Lythgoe, D.; Horder, J.; Mendez, M.A.; Wichers, R.; Ajram, L.; Ivin, G.; Heasman, M.; et al. Effects of cannabidiol on brain excitation and inhibition systems; a randomised placebo-controlled single dose trial during magnetic resonance spectroscopy in adults with and without autism spectrum disorder. Neuropsychopharmacology 2019, 44, 1398–1405.
- Cooper RE, Williams E, Seegobin S, Tye C, Kuntsi J, Asherson P. Cannabinoids in attention-deficit/hyperactivity disorder: A randomised-controlled trial. Eur Neuropsychopharmacol. 2017 Aug;27(8):795-808. doi: 10.1016/j.euroneuro.2017.05.005. Epub 2017 May 30. PMID: 28576350.
- Aran, Adi, and Dalit Cayam-Rand. “Medical Cannabis in Children.” Rambam Maimonides medical journal vol. 11,1 e0003. 30 Jan. 2020, doi:10.5041/RMMJ.10386
- Libzon S, Schleider LB, Saban N, et al. Medical cannabis for pediatric moderate to severe complex motor disorders. J Child Neurol. 2018;33:565–71. doi: 10.1177/0883073818773028.
- 117.Kuhlen M, Hoell JI, Gagnon G, et al. Effective treatment of spasticity using dronabinol in pediatric palliative care. Eur J Paediatr Neurol. 2016;20:898–903. doi: 10.1016/j.ejpn.2016.07.021.
- 118.Wilson JL, Gregory A, Wakeman K, et al. Cannabis use in children with pantothenate kinase-associated neurodegeneration. J Child Neurol. 2019;11 doi: 10.1177/0883073819890516. 883073819890516.
- Wong SS, Wilens TE. Medical cannabinoids in children and adolescents: a systematic review. Pediatrics. 2017;140 doi: 10.1542/peds.2017-1818. pii:e20171818.
- Treves, N., Mor, N., Allegaert, K. et al. Efficacy and safety of medical cannabinoids in children: a systematic review and meta-analysis. Sci Rep 11, 23462 (2021). https://doi.org/10.1038/s41598-021-02770-6





