A menopausa representa uma fase natural na vida de toda mulher, marcando o fim do período reprodutivo. Este processo, que geralmente ocorre entre os 45 e 55 anos, é acompanhado por uma série de alterações hormonais significativas que podem provocar sintomas desafiadores para muitas mulheres. Ondas de calor, insônia, alterações de humor, dores articulares e diminuição da libido são apenas alguns dos sintomas que podem comprometer a qualidade de vida durante esta transição.
Nos últimos anos, há um interesse crescente nas possíveis aplicações do canabidiol (CBD) para aliviar diversos sintomas relacionados à menopausa. O CBD é um composto não psicotrópico extraído da planta Cannabis sativa que ganhou notoriedade por suas propriedades terapêuticas. Mas será que o CBD realmente pode ajudar a amenizar os desconfortos da menopausa? No post de hoje, vamos explorar o tema de forma abrangente, fundamentada nas evidências científicas disponíveis até o momento.
O que acontece durante a menopausa?
O climatério representa uma transição biológica natural na vida da mulher, caracterizada pela progressiva passagem da fase reprodutiva para a não reprodutiva. É fundamental compreender que este período não constitui uma patologia, mas uma fase natural do desenvolvimento feminino. Muitas mulheres atravessam esta fase sem queixas significativas ou necessidade de intervenções médicas, enquanto outras experimentam sintomas de intensidade variável, que podem afetar significativamente sua qualidade de vida.¹
Temporalmente, o Ministério da Saúde define o climatério – o período que engloba a menopausa – entre os 40 e 65 anos, subdividindo-o em três fases: pré-menopausa, perimenopausa e pós-menopausa. A menopausa propriamente dita é definida pela Organização Mundial de Saúde como a cessação da função folicular ovariana, diagnosticada retrospectivamente após 12 meses consecutivos de ausência de menstruação. No Brasil, mais de 10 milhões de mulheres encontram-se nesta fase vital, o que ressalta a importância de uma compreensão individualizada deste processo para uma prática clínica adequada.¹
Fenômenos endócrinos e fisiopatologia
A jornada da menopausa envolve alterações ovarianas complexas que se iniciam ainda na vida intrauterina. O fenômeno central é a depleção progressiva dos folículos ovarianos, um processo que se acelera significativamente após os 37-38 anos. A mulher nasce com aproximadamente 1-2 milhões de folículos primordiais, número que diminui para cerca de 300-500 mil na menarca e reduz-se progressivamente até a menopausa, quando restam menos de 1.000 folículos funcionais.¹
Esta depleção folicular ocorre por dois mecanismos fundamentais: atresia folicular programada (processo apoptótico independente de gonadotrofinas) e ovulação (responsável pela eliminação de aproximadamente 450-500 folículos durante a vida reprodutiva). Com o esgotamento progressivo dos folículos, observa-se uma alteração na capacidade hormonal ovariana, resultando na redução significativa da produção estrogênica e consequente elevação das gonadotrofinas hipofisárias (FSH e LH), responsáveis pela estimulação da produção de estrogênio e progesterona.¹
A transição climatérica se caracteriza por um padrão bifásico de alterações hormonais:
- Perimenopausa precoce: Há uma diminuição da inibina B (hormônio produzido pelos ovários), com discreta elevação do FSH. Os níveis de estradiol geralmente se mantêm normais ou ligeiramente elevados, enquanto o hormônio anti-Mülleriano (AMH) diminui progressivamente.¹
- Perimenopausa tardia: As alterações se intensificam, com aumento significativo do FSH (>25 UI/L), redução progressiva do estradiol e inibina B quase indetectável. Os ciclos menstruais tornam-se irregulares e, frequentemente, anovulatórios (sem liberação de óvulo). A produção de progesterona pode ser insuficiente, o que pode levar a sangramentos anormais.¹
- Pós-menopausa estabelecida: O padrão hormonal é de FSH significativamente elevado (>40 UI/L, podendo atingir 100−150 UI/L), estradiol reduzido (<30 pg/mL), com a estrona (produzida pela conversão de outros hormônios) tornando-se o principal estrogênio circulante. Há também uma redução de 60-80% nos androgênios ovarianos. É importante ressaltar que essas mudanças são graduais e variam entre as mulheres, influenciadas por fatores genéticos, ambientais, metabólicos e imunológicos.¹
É relevante destacar que, em mulheres submetidas a procedimentos como histerectomia, a menopausa pode ocorrer artificialmente, embora os ovários possam manter seu funcionamento. Já em casos de ooforectomia bilateral (remoção cirúrgica de ambos os ovários), a menopausa é acompanhada por manifestações clínicas de hipoestrogenismo, frequentemente mais intensas que na menopausa natural.¹
Manifestações clínicas e impacto na qualidade de vida
As manifestações clínicas do climatério se expressam de forma heterogênea entre as mulheres, com variações significativas em intensidade e frequência. Dentre os sintomas mais prevalentes, destacam-se os distúrbios neurovegetativos — ou vasomotores — que acometem aproximadamente 75 a 80% das mulheres na transição menopausal. Essas manifestações são classicamente descritas como ondas de calor súbitas, geralmente acompanhadas por eritema facial, sudorese profusa e, em menor proporção, palpitações, que podem, ainda assim, ocasionar importante desconforto subjetivo¹.
Dados epidemiológicos indicam que, em mulheres com idade superior a 46 anos, os sintomas mais reportados incluem fogachos (67,8%), alterações do humor (61%), alopecia (54,5%), dispareunia (51,9%) e distúrbios do sono (53,8%). Estes últimos, frequentemente relacionados à disfunção do eixo hipotálamo-hipófise-adrenal, são mediados por alterações nos níveis plasmáticos de cortisol, o que pode intensificar quadros de ansiedade, irritabilidade e humor deprimido, perpetuando o ciclo sintomático característico dessa fase¹.
Do ponto de vista fisiopatológico, os sintomas vasomotores decorrem da instabilidade da zona termorreguladora hipotalâmica, resultante de alterações no controle central da temperatura. Esse processo envolve aumento da atividade noradrenérgica, disfunção dos receptores α2-adrenérgicos e modulação alterada dos sistemas serotoninérgico e endocanabinoide. A ativação dessa cascata culmina em vasodilatação periférica, incremento do fluxo sanguíneo cutâneo, elevação da temperatura da pele e sudorese reativa.¹
As manifestações neuropsíquicas, por sua vez, embora frequentemente exacerbadas no climatério, não são exclusivas dessa fase da vida. Quadros de ansiedade, labilidade emocional, redução da autoestima e depressão podem ocorrer de forma isolada ou concomitante, com etiologia multifatorial. A deficiência estrogênica desempenha papel relevante, mas os determinantes biopsicossociais e o histórico psicopatológico individual também contribuem significativamente para o quadro clínico.¹
No tocante à saúde sexual feminina, observa-se queda significativa da libido, geralmente associada ao hipoestrogenismo. A atrofia do epitélio vaginal, a diminuição da lubrificação e da elasticidade local contribuem para o surgimento de dispareunia e, consequentemente, para a deterioração da função sexual. Este cenário não se restringe à esfera íntima, pois reflete-se em importantes repercussões emocionais e relacionais.¹
Além disso, o desequilíbrio hormonal inerente ao climatério associa-se a desfechos metabólicos adversos, como aumento da adiposidade visceral, resistência insulínica, dislipidemia aterogênica, ativação do sistema renina-angiotensina-aldosterona e aumento de marcadores inflamatórios sistêmicos — todos contribuindo para o incremento do risco cardiovascular em 2 a 4 vezes após a menopausa, independentemente do envelhecimento cronológico.¹
O comprometimento ósseo também merece destaque. A deficiência estrogênica intensifica a atividade osteoclástica em detrimento da osteoblástica, favorecendo a reabsorção óssea acelerada. Esse processo é mediado por aumento da expressão de RANKL, redução da osteoprotegerina e elevação de citocinas pró-inflamatórias. Como resultado, a densidade mineral óssea sofre perdas significativas nos primeiros cinco a sete anos após a menopausa — entre 2 a 5% ao ano — particularmente em osso trabecular, elevando substancialmente o risco de fraturas osteoporóticas.¹
Desafios no tratamento e novas perspectivas
Apesar da disponibilidade de diversas abordagens terapêuticas convencionais, como a terapia hormonal (TH) e o uso de antidepressivos, ansiolíticos ou moduladores seletivos de receptores estrogênicos (SERMs), uma parcela significativa das pacientes não apresenta remissão sintomática satisfatória ou manifesta intolerância aos efeitos adversos desses tratamentos. As limitações e desafios do manejo terapêutico atual podem ser atribuídos a diversos fatores:
- Resposta terapêutica variável: A eficácia das intervenções nem sempre é universal para todos os sintomas ou para todas as pacientes. Por exemplo, enquanto a TH pode ser altamente eficaz para sintomas vasomotores, sua capacidade de mitigar completamente alterações de humor ou distúrbios do sono pode ser inconsistente em algumas mulheres, demonstrando uma ampla variabilidade individual na resposta.
- Perfil de segurança e efeitos adversos: Os tratamentos hormonais, embora clinicamente eficazes para muitos sintomas, podem estar associados a riscos inerentes, como o aumento do risco de eventos tromboembólicos, complicações cardiovasculares ou a incidência de certas neoplasias em subgrupos específicos de pacientes. Da mesma forma, antidepressivos e ansiolíticos podem induzir efeitos indesejados como sedação, ganho ponderal e disfunção sexual, que podem comprometer a qualidade de vida da paciente e a adesão ao tratamento.
- Contraindicações clínicas: Um número considerável de pacientes não é elegível para a terapia hormonal devido a comorbidades ou histórico médico preexistente, incluindo carcinoma mamário, hepatopatias ativas, trombose venosa profunda ou sangramento vaginal de etiologia inexplicada. Essa restrição limita substancialmente as opções terapêuticas disponíveis para uma parcela significativa da população feminina climatérica.
- Adesão ao tratamento comprometida: A ocorrência de efeitos adversos, a percepção de uma melhora sintomática subótima, a complexidade dos regimes posológicos ou, ainda, o estigma associado a determinadas classes de medicamentos podem levar à descontinuação do tratamento por parte das pacientes, impactando negativamente os desfechos clínicos.
- Abordagem sintomática fragmentada: As estratégias terapêuticas convencionais frequentemente se concentram no manejo isolado de sintomas específicos (e.g., um fármaco para fogachos, outro para depressão). No entanto, a sintomatologia do climatério é interconectada e multifacetada. Uma abordagem que não contemple essa complexidade e a interação entre os sintomas pode ser insuficiente para promover um alívio global e sustentável.
Diante desse cenário, o potencial do canabidiol como parte da intervenção multimodal para o climatério tem emergido como uma área de crescente interesse. Seus efeitos ansiolíticos, moduladores do sono, neuroprotetores e sua atuação sobre o sistema endocanabinoide o posicionam como uma estratégia promissora no manejo de múltiplos sintomas climatéricos, especialmente naquelas mulheres que não encontram alívio satisfatório com as terapias tradicionais
Sistema Endocanabinoide e Menopausa
A menopausa representa uma transição fisiológica natural na vida da mulher, marcada por mudanças hormonais profundas e, frequentemente, acompanhada por uma série de sintomas físicos e emocionais que impactam a qualidade de vida. Entre os muitos sistemas afetados por essa transição, o sistema endocanabinoide (SEC) tem despertado crescente interesse como um potencial modulador de vários processos envolvidos na fisiopatologia da menopausa.
O SEC é um complexo sistema de sinalização endógeno, composto por receptores canabinoides (CB1 e CB2), seus ligantes endógenos — principalmente a anandamida (AEA) e o 2-araquidonoilglicerol (2-AG) — e enzimas responsáveis pela sua síntese (como NAPE-PLD e DAGL) e degradação (como FAAH e MAGL). Sua presença está documentada em múltiplos tecidos e sistemas, participando ativamente da regulação de funções tão diversas quanto o apetite, a inflamação, a dor, o humor, o sono e a homeostase energética.²
Na transição para a menopausa, os níveis de estrogênio e progesterona caem drasticamente, o que repercute diretamente na atividade do SEC. Estudos indicam que o 17β-estradiol pode estimular a liberação de anandamida e inibir a ação da FAAH, aumentando a disponibilidade desse endocanabinoide. Assim, a queda estrogênica típica da menopausa leva a uma redução dos níveis de AEA, além de afetar negativamente a expressão e a sinalização dos receptores CB2, com implicações funcionais ainda pouco exploradas, mas potencialmente relevantes.³
Essas alterações podem estar na base de vários sintomas e condições frequentemente observados nessa fase da vida. Por exemplo, no contexto da obesidade, sabe-se que os receptores CB1 e CB2 estão envolvidos na regulação do metabolismo lipídico e da adipogênese. Mulheres na pós-menopausa, sobretudo as com obesidade, apresentam níveis elevados de endocanabinoides circulantes, associados à redução da atividade da FAAH. Além disso, variantes genéticas do receptor CB1 parecem influenciar a distribuição de gordura e o risco metabólico nesse grupo.³
No tecido ósseo, a influência do SEC também é significativa. A deficiência estrogênica acelera a perda óssea, favorecendo a atividade osteoclástica e aumentando o risco de osteoporose. O receptor CB1, quando ativado, estimula a atividade dos osteoclastos, enquanto o CB2 exerce efeitos antagônicos, promovendo a função osteoblástica. Polimorfismos nos genes que codificam esses receptores têm sido associados a diferentes perfis de densidade mineral óssea em mulheres na pós-menopausa.³
No que se refere ao sistema cardiovascular, a queda dos níveis de estrogênio está associada a um aumento do risco de eventos adversos, como hipertensão arterial e disfunção endotelial. O SEC, por sua vez, exerce um papel modulador importante na função vascular. A anandamida pode induzir vasodilatação por meio do aumento da liberação de óxido nítrico, e a ativação dos receptores CB2 favorece a dilatação das arteríolas via eNOS, melhorando o fluxo sanguíneo e contribuindo para a redução do risco cardiovascular.³
A deficiência estrogênica, ao reduzir a expressão de CB1 no tecido cardíaco, pode comprometer esse efeito protetor. No entanto, evidências experimentais sugerem que essa disfunção é, ao menos parcialmente, reversível. Em modelo animal de depleção estrogênica, observou-se que a administração de anandamida por duas semanas foi capaz de restaurar os níveis do receptor CB1 no miocárdio, atingindo valores comparáveis aos de animais controle com função ovariana preservada. Esses achados indicam que a AEA, isoladamente ou em combinação com o 17β-estradiol, exerce um efeito modulador sobre a sinalização canabinoide cardíaca, o que pode representar uma estratégia terapêutica promissora na prevenção de alterações cardiovasculares associadas ao hipoestrogenismo.4
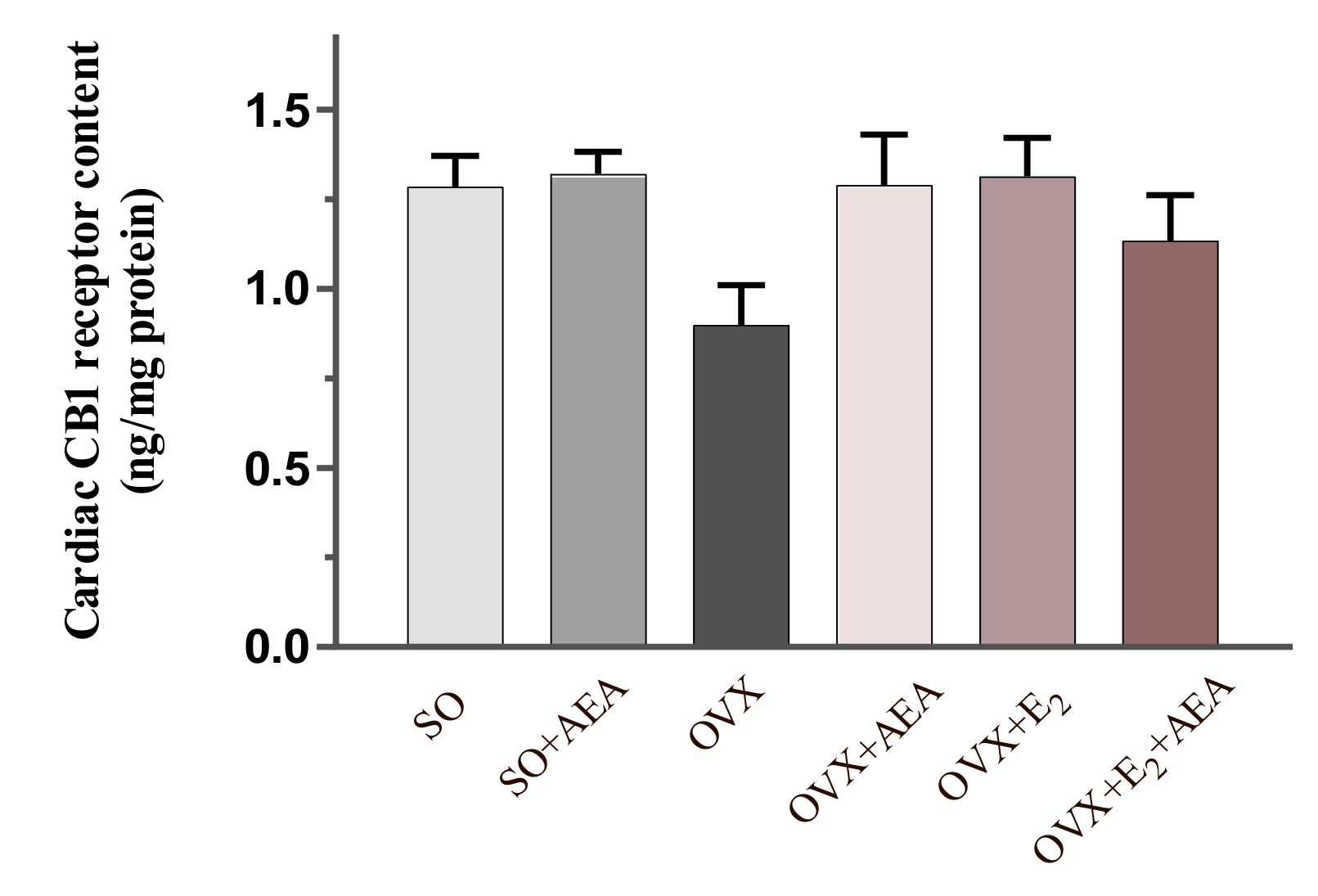
Ainda mais intrigante é o potencial papel do SEC na prevenção e controle do câncer, especialmente em um contexto pós-menopáusico, onde há alteração na regulação proliferativa hormonal. A anandamida e outros endocanabinoides apresentam propriedades antiproliferativas, induzindo apoptose, bloqueando o ciclo celular e reduzindo a angiogênese tumoral em diversos modelos celulares. O fato de células tumorais apresentarem maior sensibilidade aos endocanabinoides do que células saudáveis reforça o interesse nesse sistema como alvo terapêutico, sobretudo em fases da vida em que os mecanismos regulatórios naturais estão alterados, como ocorre na menopausa.³
Diante desse cenário, o SEC emerge como um sistema de regulação transversal, cuja modulação pode oferecer novas estratégias para o manejo das manifestações clínicas associadas à menopausa. O uso de canabinoides — especialmente o canabidiol — apresenta-se como uma via terapêutica promissora. A compreensão da relação entre o SEC e os hormônios sexuais femininos permite vislumbrar intervenções terapêuticas mais individualizadas, seguras e potencialmente eficazes, contribuindo para a melhoria da saúde e da qualidade de vida de mulheres na pós-menopausa.
Potenciais benefícios do CBD para sintomas da menopausa
A transição para a menopausa, marcada pela queda nos níveis de 17β-estradiol (E2), está associada a uma série de alterações fisiológicas desfavoráveis. Embora a terapia de reposição hormonal (TRH) tenha sido, por décadas, o principal recurso terapêutico para o manejo desses efeitos, seu perfil risco-benefício tem sido cada vez mais questionado, especialmente em mulheres na pós-menopausa com contraindicações ou preocupações com os eventos adversos associados à terapia estrogênica.Nesse cenário, cresce o interesse científico por alternativas terapêuticas seguras e eficazes — entre elas, o canabidiol.
Apesar da escassez de estudos clínicos especificamente conduzidos em mulheres no climatério ou na pós-menopausa, há um crescente corpo de evidências que sustenta os efeitos terapêuticos do canabidiol sobre diversos sintomas que se manifestam com frequência nesse período da vida. Distúrbios do sono, alterações de humor, dor crônica e perda de densidade óssea são queixas prevalentes entre mulheres menopausadas, e vêm sendo objeto de investigações pré-clínicas e clínicas em diferentes contextos.
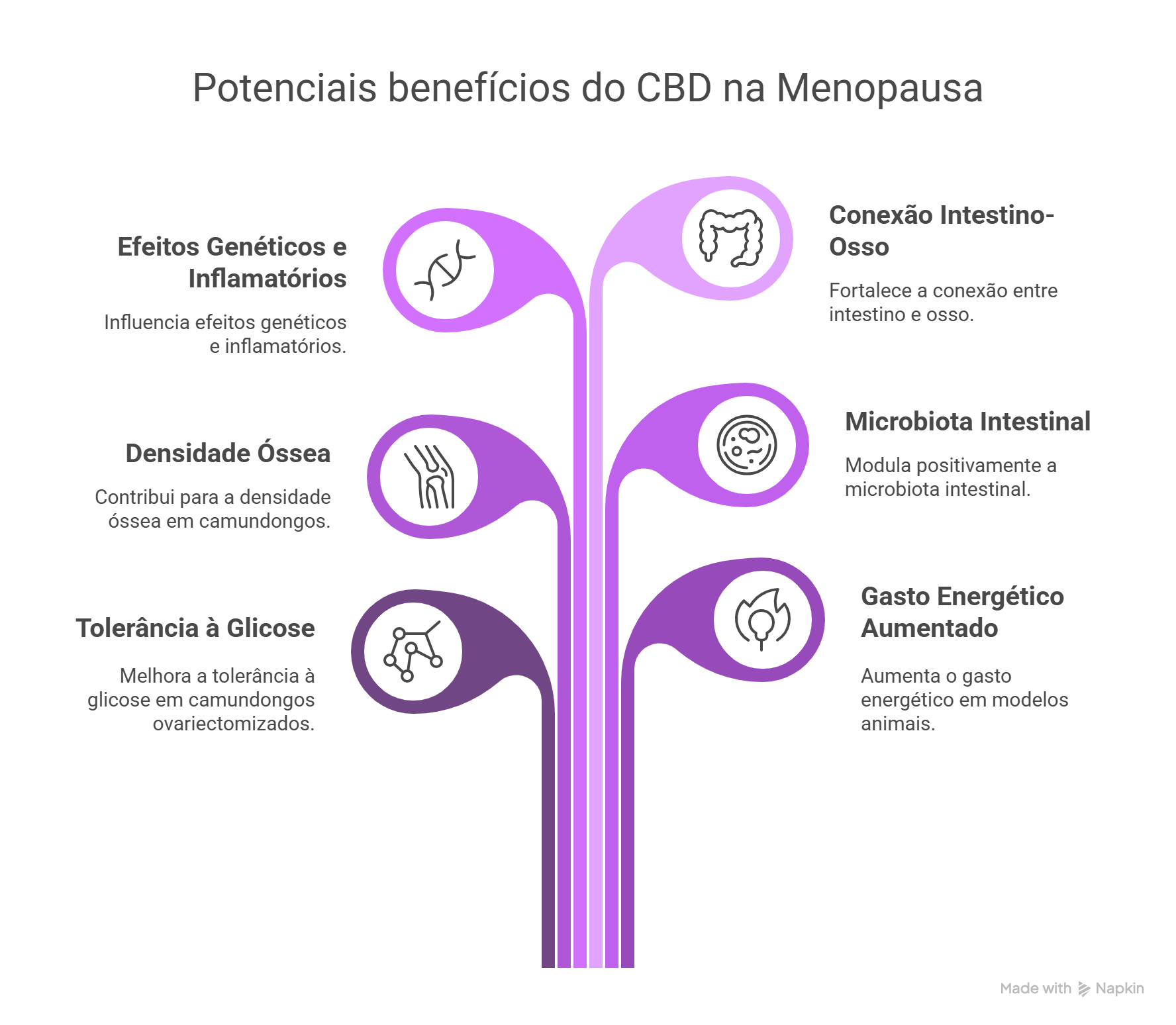
Um estudo pré-clínico recente publicado na Frontiers in Pharmacology, foi conduzido em camundongos ovariectomizados (OVX), modelo amplamente utilizado para simular a deficiência estrogênica da pós-menopausa, mostrou que o tratamento com CBD (25 mg/kg por via oral durante 18 semanas) resultou em múltiplos benefícios fisiológicos.5
Observou-se melhora na tolerância à glicose, aumento do gasto energético, incremento significativo na densidade mineral óssea corporal e volumétrica, além de alterações na microbiota intestinal com maior abundância de Lactobacillus. Esses achados foram acompanhados por uma regulação gênica compatível com menor inflamação intestinal e menor reabsorção óssea, sugerindo um potencial efeito protetor do CBD sobre o metabolismo ósseo e o eixo intestino-osso.5
Para além dos estudos pré-clínicos, pesquisas mais recentes têm explorado o uso de canabinoides diretamente em mulheres na perimenopausa e pós-menopausa, fornecendo dados importantes sobre a percepção e a utilidade do CBD para os sintomas relacionados à menopausa.
Uma pesquisa publicada na revista Menopause investigou o uso de cannabis por 258 mulheres na perimenopausa e pós-menopausa. Os resultados foram bastante relevantes: a maioria das participantes (86,1%) relatou usar cannabis, e quase 79% o faziam especificamente para aliviar sintomas da menopausa. Entre os sintomas mais comuns tratados com cannabis, destacaram-se distúrbios do sono (67,4%) e humor/ansiedade (46,1%).6
É interessante notar que mulheres na perimenopausa, que geralmente experimentam sintomas mais intensos como ansiedade, depressão e ondas de calor mais severas, mostraram uma maior inclinação a usar cannabis medicinal para lidar com esses problemas de humor/ansiedade em comparação com as mulheres na pós-menopausa. Esses achados sugerem que o CBD pode ser uma ferramenta promissora para futuras pesquisas e ensaios clínicos focados em terapias com canabinoides para essa população.6
Outro estudo transversal significativo, publicado no BMJ Open, envolveu mais de 1.400 mulheres com 35 anos ou mais em Alberta, Canadá. Os dados revelaram que 34% das participantes usavam cannabis atualmente, e 66% já haviam feito uso em algum momento. Destaca-se que, entre as que faziam uso regular, mais de 75% empregavam a cannabis para fins medicinais.7
As principais razões para o uso incluíam melhora do sono (65%), redução da ansiedade (45%) e alívio da dor muscular/articular (33%). Impressionantemente, 74% dessas mulheres consideraram a cannabis útil para seus sintomas. O estudo também observou que mulheres que relatavam sintomas da menopausa eram mais propensas a usar cannabis, o que sugere que elas estavam buscando alívio para esses desconfortos. Isso reforça a relevância do canabidiol como uma opção potencial nesse cenário.7
Embora ainda haja escassez de ensaios clínicos randomizados de grande escala, séries de casos também começam a trazer evidências. Uma série de casos em duas mulheres na pós-menopausa com osteopenia, publicada em Cannabis and Cannabinoid Research, investigou os efeitos da administração oral de CBD (100 ou 300 mg/dia por 12 semanas) na renovação óssea. O CBD foi bem tolerado e associado à redução de marcadores de reabsorção e formação óssea, sugerindo um potencial efeito protetor ósseo que demanda investigação em estudos maiores.8
Estudos de coorte com larga amostragem corroboram os efeitos do canabidiol em sintomas relevantes nesse contexto. Uma investigação israelense com 3.000 pacientes mostrou que cerca de 74% relataram redução nos sintomas de ansiedade e depressão após o início de canabinoides; 70% relataram melhora do sono e 55% redução da fadiga — sintomas que frequentemente impactam a qualidade de vida das mulheres em transição menopausal.9
Outro estudo prospectivo, envolvendo mais de 10.000 pacientes, evidenciou que após seis meses de tratamento com cannabis medicinal, aproximadamente 65% apresentaram redução superior a 30% na intensidade da dor. Melhorias significativas também foram observadas em aspectos como distúrbios do sono (89,1%), agitação (89,5%) e náuseas (88,9%), com consequente aumento na proporção de pacientes classificando sua qualidade de vida como “boa” — de 12,9% para 69,9%.10
É importante notar que uma revisão sistemática publicada na revista Climacteric, que avaliou o impacto da cannabis em sintomas como fogachos, humor, insônia e sexualidade em mulheres na perimenopausa e pós-menopausa, apontou uma escassez de pesquisas robustas. De 564 estudos encontrados, apenas três preencheram os critérios de inclusão, e a maioria focava em expectativas ou associações, não em ensaios clínicos controlados e rigorosos.11 Isso sublinha a necessidade urgente de mais pesquisas sobre o uso da cannabis na menopausa, especialmente estudos clínicos bem desenhados que possam comprovar sua segurança e eficácia. O entusiasmo das mulheres em buscar essa alternativa é, por si só, um forte motivador para que a ciência avance rapidamente nessa área.
No entanto, é fundamental destacar que, mesmo diante dessa escassez de evidências clínicas, os resultados preliminares e os dados de uso real são encorajadores e sugerem um potencial terapêutico significativo. A sobreposição dos sintomas da menopausa com as condições para as quais o CBD já demonstra eficácia em outros contextos — somada às evidências emergentes de seu uso direto por mulheres nessa fase da vida — justifica plenamente o crescente interesse pelo CBD como uma abordagem terapêutica complementar.
Para mulheres que não podem ou não desejam usar a terapia hormonal, o CBD surge como uma alternativa inovadora e promissora. A incorporação estratégica e racional do CBD nas diretrizes clínicas de manejo da menopausa pode não apenas aliviar sintomas comuns, mas também abrir caminho para um futuro onde mais mulheres possam desfrutar de uma melhor qualidade de vida durante essa transição natural. O potencial terapêutico do CBD é um campo fértil para avanços científicos e clínicos que podem revolucionar o bem-estar feminino.
Conclusão
A menopausa é uma fase natural e complexa na vida da mulher, que traz consigo uma série de alterações hormonais e sintomas desafiadores. Apesar das abordagens terapêuticas tradicionais, nem todas as mulheres encontram alívio satisfatório. Nesse contexto, o canabidiol se apresenta como uma alternativa promissora para o manejo dos sintomas relacionados à menopausa.
Embora ainda existam lacunas no entendimento completo dos mecanismos de ação do CBD, as evidências disponíveis sugerem que ele pode ser eficaz na modulação do sistema endocanabinoide e na mitigação de vários sintomas do climatério. Portanto, é fundamental que mais estudos sejam conduzidos para esclarecer seu potencial terapêutico e segurança, garantindo que o CBD possa ser integrado de forma segura e eficaz no tratamento das mulheres durante a transição para a menopausa.
ELEVE SUA PRÁTICA CLÍNICA A UM NOVO PATAMAR
Após explorar o potencial do Canabidiol no manejo dos sintomas da menopausa, convidamos você para dar o próximo passo em sua jornada profissional com o WeCann Summit 2025 – o mais importante evento internacional dedicado à medicina endocanabinoide e inovações terapêuticas na saúde.
O WeCann Summit 2025, que acontecerá nos dias 23, 24 e 25 de outubro no Royal Palm Hall, em Campinas, representa uma oportunidade única para aprofundar seu conhecimento sobre o sistema endocanabinoide, suas aplicações clínicas em diversas condições, e novas e promissoras fronteiras da Medicina, como sistemas de suporte à decisão clínica baseados em Inteligência Artificial.
Este evento reúne experts de quatro continentes, oferecendo:
- Conteúdo técnico altamente qualificado;
- Protocolos práticos para implementação imediata em seu consultório;
- Rede de contatos com especialistas e colegas de +50 especialidades e áreas de atuação.
O WeCann Summit 2025 é mais do que um congresso médico: é o ponto de encontro entre ciência, inovação e prática médica de excelência.
Seu passaporte para novas fronteiras da Medicina está disponível apertando no botão abaixo:
Referências
-
- OLIVEIRA, L. E. de A. .; LIMA, V. C. F. de .; SILVA , A. . O. da .; SANTOS, D. Ítalo F. dos .; PADILHA, D. de M. M. . Menopause and behavioral effects: How to proceed? Literature review. Research, Society and Development, [S. l.], v. 12, n. 1, p. e12112139479, 2023. DOI: 10.33448/rsd-v12i1.39479. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/39479. Acesso em: 19 apr. 2025.
- MONTAGNER,Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Torella M, Tortora C, Argenziano M, Di Paola A, Riemma G, Di Leva C, te al. The Role of Endocannabinoid System in Menopause and Its Related-Diseases. Austin J Obstet Gynecol. 2021; 8(4): 1177.
- Szabó R, Börzsei D, Szabó Z, Hoffmann A, Zupkó I, Priksz D, Kupai K, Varga C, Pósa A. A Potential Involvement of Anandamide in the Modulation of HO/NOS Systems: Women, Menopause, and “Medical Cannabinoids”. Int J Mol Sci. 2020 Nov 20;21(22):8801. doi: 10.3390/ijms21228801. PMID: 33233803; PMCID: PMC7699915.
- SUI, Ke et al. Cannabidiol-treated ovariectomized mice show improved glucose, energy, and bone metabolism with a bloom in Lactobacillus. Frontiers in Pharmacology, Lausanne, v. 13, 2022. Disponível em: https://www.frontiersin.org/journals/pharmacology/articles/10.3389/fphar.2022.900667.DOI: https://doi.org/10.3389/fphar.2022.900667. ISSN 1663-9812.
- Dahlgren MK, El-Abboud C, Lambros AM, Sagar KA, Smith RT, Gruber SA. A survey of medical cannabis use during perimenopause and postmenopause. Menopause. 2022 Sep 1;29(9):1028-1036. doi: 10.1097/GME.0000000000002018. Epub 2022 Aug 2. PMID: 35917529; PMCID: PMC9422771.
- Babyn K, Ross S, Makowsky M, Kiang T, Yuksel N. Cannabis use for menopause in women aged 35 and over: a cross-sectional survey on usage patterns and perceptions in Alberta, Canada. BMJ Open. 2023 Jun 21;13(6):e069197. doi: 10.1136/bmjopen-2022-069197. PMID: 37344107; PMCID: PMC10314536.
- Kulpa J, Harrison A, Rudolph L, Eglit GML, Turcotte C, Bonn-Miller MO, Peters EN. Oral Cannabidiol Treatment in Two Postmenopausal Women with Osteopenia: A Case Series. Cannabis Cannabinoid Res. 2023 Sep;8(S1):S83-S89. doi: 10.1089/can.2023.0060. PMID: 37721991.
- Bar-Lev Schleider, L. et al. Prospective analysis of safety and efficacy of medical cannabis in large unselected population of patients with cancer. Eur; J. Intern. Med. 49, 37-43 (2018).
- Bar-Ley Schleider, L., Mechoulam, R., Sikorin, I., Naftali, T. & Novack, V. Adherence, Safety, and Effectiveness of Medical Cannabis and Epidemiological Characteristics of the Paticnt Population: A Prospective Study. Front. Med. 9, 827849 (2022).
- Mejia-Gomez J, Phung N, Philippopoulos E, Murphy KE, Wolfman W. The impact of cannabis use on vasomotor symptoms, mood, insomnia and sexuality in perimenopausal and postmenopausal women: a systematic review. Climacteric. 2021 Dec;24(6):572-576. doi: 10.1080/13697137.2021.1898581. Epub 2021 Mar 24. PMID: 33759668.





