A encefalopatia hipóxico-isquêmica (EHI) neonatal é uma das principais causas de mortalidade e morbidade neurológica em recém-nascidos, frequentemente associada a eventos de hipóxia e isquemia cerebral durante o parto. Apesar do avanço na identificação precoce e nos tratamentos, como a hipotermia terapêutica, os desfechos neurológicos a longo prazo ainda são insatisfatórios para muitos pacientes. Nesse contexto, os canabinoides têm emergido como potenciais agentes terapêuticos, devido às suas propriedades neuroprotetoras e anti-inflamatórias. No post de hoje abordar os mecanismos de ação dos canabinoides, sua aplicabilidade no tratamento da EHI e as evidências científicas disponíveis até o momento.
Encefalopatia Hipóxico-Isquêmica
A encefalopatia hipóxico-isquêmica neonatal (EHI) continua sendo uma das principais causas de lesões neurológicas em recém-nascidos, com implicações que se estendem ao longo do desenvolvimento infantil. O impacto dessa condição é profundo, com um grande número de crianças apresentando deficiências motoras, cognitivas e sensoriais de longo prazo. A prevalência dessa patologia, associada a complicações decorrentes da asfixia perinatal, varia entre 0,5% e 1% de todos os nascimentos, com até 75% dos casos evoluindo para sequelas neurológicas significativas. Tais lesões têm implicações não apenas para o indivíduo afetado, mas também para as famílias e para o sistema de saúde, evidenciando a urgência de avanços terapêuticos eficazes.
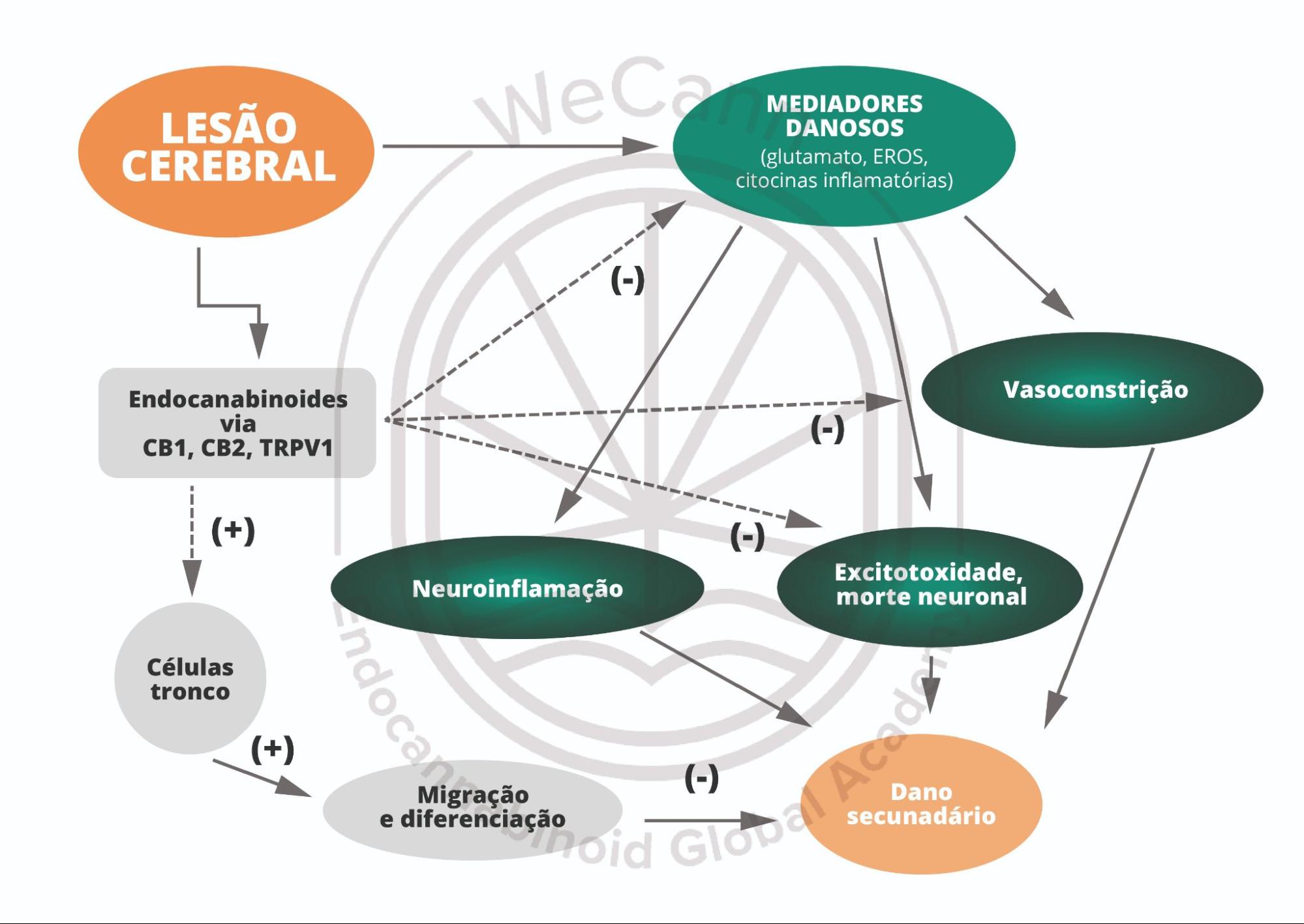
A EHI resulta da privação de oxigênio e/ou fluxo sanguíneo no cérebro de recém-nascidos, geralmente associada a complicações perinatais, como asfixia, prematuridade, distúrbios no cordão umbilical ou complicações durante o trabalho de parto. Esses episódios de hipóxia e isquemia causam danos cerebrais significativos, uma vez que o cérebro neonatal é particularmente vulnerável a esses insultos devido ao seu desenvolvimento incompleto e à imaturidade das suas funções neurofisiológicas. A etiologia da EHI envolve uma combinação de fatores, como a diminuição do fornecimento de oxigênio e nutrientes ao cérebro, que desencadeiam uma série de eventos celulares destrutivos, como a excitotoxicidade, o estresse oxidativo e a inflamação. Esses mecanismos fisiopatológicos levam à morte neuronal e ao comprometimento do desenvolvimento cerebral.¹
A fisiopatologia da EHI é complexa e envolve uma série de processos interconectados que causam dano neuronal e morte celular. Entre os principais mecanismos, destaca-se a excitotoxicidade, onde a ativação excessiva de receptores de glutamato, em resposta à hipóxia-isquemia, provoca o influxo descontrolado de cálcio nas células. Esse excesso de cálcio danifica as estruturas celulares essenciais, como as mitocôndrias e o citoesqueleto, além de desencadear vias que levam à morte celular.¹
O estresse oxidativo também desempenha um papel central, uma vez que a disfunção mitocondrial e o aumento de radicais livres resultam em danos a proteínas, lipídios e DNA, exacerbando ainda mais a lesão neuronal. A neuroinflamação é outro mecanismo crítico, com a ativação da microglia e a liberação de citocinas pró-inflamatórias criando um ambiente neurotóxico que intensifica o dano cerebral. A disfunção mitocondrial, por sua vez, compromete a produção de ATP, essencial para a função celular, ampliando a excitotoxicidade e o estresse oxidativo. As alterações na perfusão cerebral devido à redução do fluxo sanguíneo cerebral e à falência da autoregulação cerebral agravam ainda mais o quadro de lesão, resultando em hipóxia adicional. Esses eventos em cascata culminam na morte neuronal e no desenvolvimento de déficits cognitivos e motores, característicos da EHI.¹
Clinicamente, a EHI pode se manifestar por uma variedade de sintomas, dependendo da gravidade e da extensão do dano cerebral. Os sinais clínicos incluem dificuldades respiratórias, convulsões, alterações no tônus muscular, e, em casos mais graves, coma ou ausência de resposta a estímulos. As consequências a longo prazo podem incluir deficiências neurológicas, como paralisia cerebral, atraso no desenvolvimento motor e cognitivo, dificuldades de aprendizagem e distúrbios comportamentais. O diagnóstico precoce é fundamental para a implementação de terapias adequadas, como a hipotermia terapêutica, que visa reduzir os danos e melhorar os desfechos neurológicos.¹
O tratamento atual, predominantemente baseado na hipotermia terapêutica, apresenta resultados clínicos variáveis, com eficácia limitada em muitos casos, particularmente em neonatos de baixo peso ou com lesões cerebrais extensas. Embora a hipotermia tenha mostrado eficácia em retardar a cascata de lesões celulares, ela não é capaz de impedir totalmente a evolução do dano neurológico, o que reforça a necessidade de novas abordagens terapêuticas.¹
Nesse cenário, os canabinoides emergem como agentes promissores no tratamento de lesões cerebrais, devido à sua capacidade única de modular tanto a atividade neuronal quanto a resposta inflamatória. O sistema endocanabinoide, com seu papel crucial na regulação dessas funções, oferece novas perspectivas para o desenvolvimento de terapias neuroprotetoras eficazes. Essa abordagem torna-se particularmente relevante em condições desafiadoras, como a encefalopatia hipóxico-isquêmica neonatal, onde a intervenção precoce e eficaz pode mitigar os danos cerebrais e melhorar os desfechos clínicos.
Sistema endocanabinoide e Encefalopatia Hipóxico-Isquêmica
O sistema endocanabinoide (SEC) é uma rede complexa de sinalização que desempenha um papel fundamental na regulação de diversos processos fisiológicos no corpo humano, incluindo o controle da dor, do humor, do apetite, da memória, da inflamação e da neuroproteção. Esse sistema é composto por ligantes endógenos, como a anandamida (AEA) e o 2-arquidoilglicerol (2-AG), que se ligam a dois principais tipos de receptores: o CB1, amplamente expresso no sistema nervoso central, e o CB2, presente principalmente em células do sistema imunológico e periférico.²
Além desses componentes, as enzimas responsáveis pela síntese e degradação dos canabinoides também desempenham papel essencial na regulação do sistema. A capacidade do SEC de modular uma série de respostas biológicas essenciais torna-o um alvo de crescente interesse em terapias para diversas condições clínicas, incluindo doenças neurodegenerativas, distúrbios inflamatórios e, mais recentemente, em modelos de lesão cerebral, como a encefalopatia hipóxico-isquêmica.²
A sinalização do sistema endocanabinoide desempenha um papel crucial no desenvolvimento e na maturação do sistema nervoso central (SNC), influenciando uma série de processos como neurogênese, migração neuronal e sinaptogênese, aspectos fundamentais para a integridade neural. No contexto da EHI, as alterações nos níveis de ligantes endocanabinoides e a modulação dos receptores CB1 e CB2 podem afetar diretamente a resposta cerebral a lesões, impactando a reparação e a neuroproteção após eventos de hipóxia e isquemia.³
Para saber mais sobre o papel da Cannabis na Excitabilidade Cerebral acesse: Efeitos da Cannabis na Excitabilidade Cerebral – WeCann Academy
Estudos demonstram que os receptores CB1 estão amplamente envolvidos no desenvolvimento do SNC, com uma expressão significativa durante os estágios embrionários e pós-natais, sendo responsáveis por regular a migração e diferenciação neuronal. Esses receptores, além de serem amplamente expressos nas células neuronais, também estão presentes em células não neuronais, como astrócitos e oligodendrócitos, que desempenham um papel essencial na neurogênese e na reparação das vias neuronais após lesões. Essa função do CB1, particularmente na migração neuronal e no alongamento axonal, é fundamental para o restabelecimento das conexões neurais após eventos de hipóxia e isquemia.²
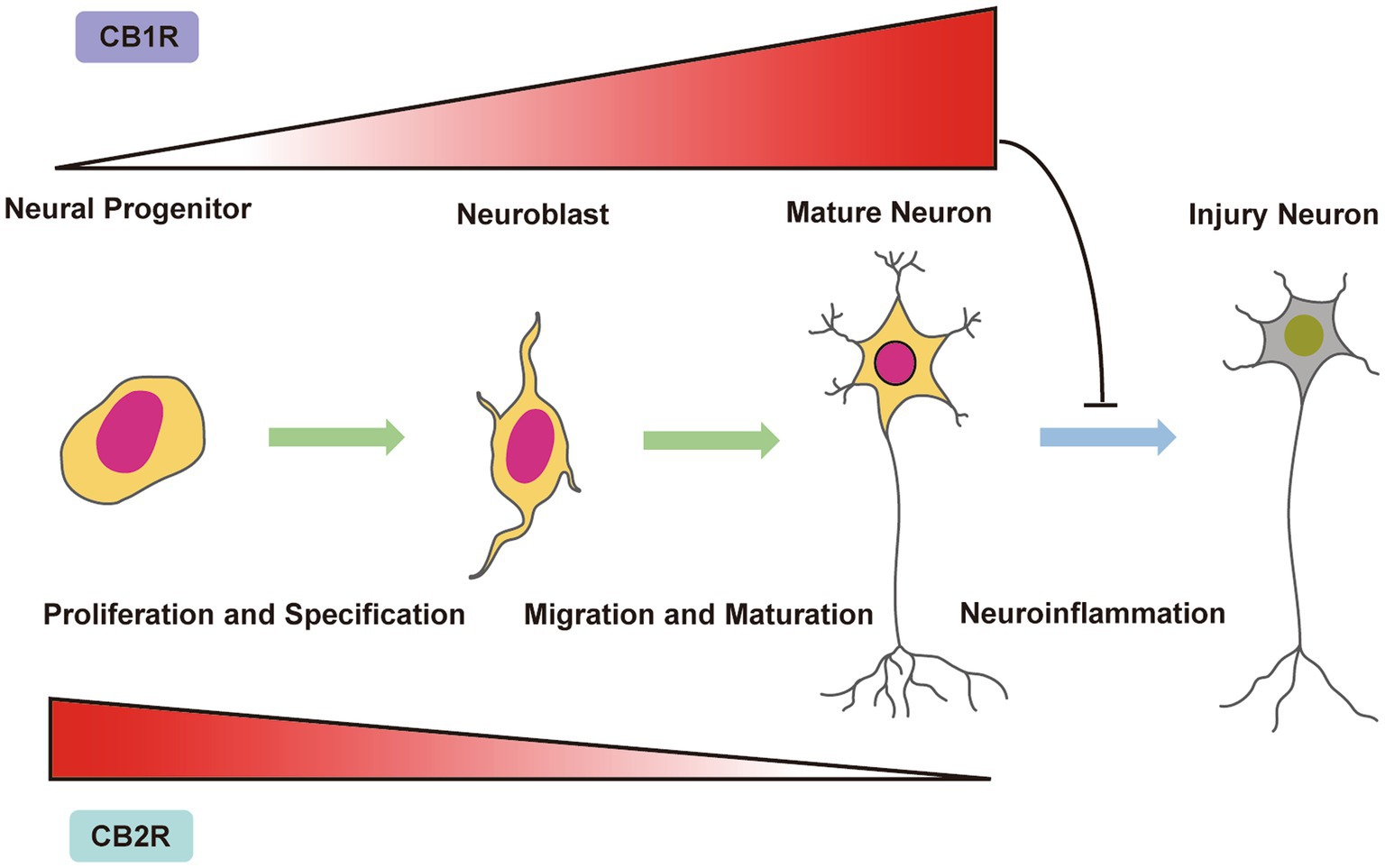
No caso da EHI, a sinalização do sistema endocanabinoide tem mostrado um papel duplo. De um lado, a ativação do receptor CB1, em resposta ao aumento de AEA ou 2-AG, pode exercer efeitos neuroprotetores, como a diminuição da inflamação neural e o estímulo da neurogênese/gliogênese em regiões afetadas.
O SEC, notavelmente o receptor CB1, atua como um “disjuntor de circuito sináptico”, crucial na prevenção da liberação excessiva de glutamato e da consequente excitotoxicidade. Esse sistema opera sob demanda, de forma sinapse-específica, liberando endocanabinoides, principalmente o 2-AG, em resposta a estímulos fisiológicos precisamente cronometrados. O 2-AG é sintetizado na membrana pós-sináptica pela ativação de receptores metabotrópicos de glutamato tipo 1 (mGluRs), especialmente mGluR5, que são ativados pelo transbordamento de glutamato de uma atividade pré-sináptica excessiva. O 2-AG, então, viaja retrogradamente para ativar os receptores CB1 localizados nos terminais pré-sinápticos..
A ativação dos receptores CB1 pré-sinápticos resulta consistentemente na atenuação da liberação de neurotransmissores, funcionando como um mecanismo neuroprotetor contra a excitotoxicidade. Em condições patológicas, como lesões traumáticas, isquemia cerebral ou convulsões epilépticas, onde há um aumento da abundância de glutamato, o SEC age para modular essa atividade. A promoção da sinalização endocanabinoide em sinapses glutamatérgicas é benéfica na epilepsia, enquanto o bloqueio do CB1 pode reduzir o limiar de convulsão e aumentar a morte neuronal. Em pacientes com epilepsia do lobo temporal, observa-se uma redução na expressão de CB1 e DGL−α nos terminais de axônios glutamatérgicos, indicando um comprometimento desse maquinário neuroprotetor.4
Por outro lado, a modulação dos receptores CB2, que desempenham um papel central na regulação da inflamação, pode ser um mecanismo crucial para mitigar os danos relacionados ao processo isquêmico. Em particular, a ativação do receptor CB2 tem sido associada à diminuição da neuroinflamação e à proteção contra a morte neuronal induzida pela hipóxia.³
Estudos em modelos experimentais de EHI têm revelado que a modulação da sinalização endocanabinoide, particularmente a ativação dos receptores CB2, pode ter efeitos terapêuticos significativos ao promover a sobrevivência neuronal e reduzir a extensão dos danos cerebrais. A ativação do receptor CB2 pode influenciar a migração de células progenitoras neurais para as regiões danificadas e facilitar a regeneração celular, principalmente em situações de neuroinflamação, como as observadas após lesões hipóxico-isquêmicas. Além disso, a regulação da sinalização canabinoide poderia otimizar a neurogênese/gliogênese adulta e a maturação de células neuronais e gliais nas áreas afetadas, apoiando a recuperação do tecido cerebral.³
Portanto, a modulação do sistema endocanabinoide pode representar uma estratégia terapêutica promissora no tratamento da encefalopatia hipóxico-isquêmica. A regulação fina dos receptores CB1 e CB2 e a manipulação dos níveis de ligantes endocanabinoides, como AEA e 2-AG, poderia ajudar na recuperação funcional do SNC após lesões, reduzindo tanto a inflamação quanto a morte celular, ao mesmo tempo em que promove a neurogênese/gliogênese e a restauração das conexões neuronais danificadas.
Evidências científicas
Diversos estudos têm explorado o papel do sistema canabinoide e endocanabinoide em processos neuroprotetores, destacando seu envolvimento em atividades como a regulação da homeostase, modulação de respostas imunológicas e inflamatórias, ativação de vias de sinalização citoprotetora, além de influências na plasticidade sináptica e transmissões glutamatérgicas excitatórias. Essas propriedades, associadas às ações hipotérmicas e antioxidantes dos canabinoides, sugerem que esse sistema pode desempenhar um importante papel na proteção contra lesões cerebrais hipóxico-isquêmicas, tanto agudas quanto crônicas.
Em modelos experimentais in vitro e in vivo, os canabinoides têm demonstrado propriedades antioxidantes significativas. Por exemplo, sua capacidade de reduzir a temperatura corporal em modelos animais, como observado com o agonista sintético CB1 HU-210, sugere que a hipotermia pode potencializar seus efeitos neuroprotetores. Estudos indicam que a eficácia neuroprotetora de canabinoides é reduzida quando a temperatura corporal retorna aos níveis normais, sugerindo que condições hipotérmicas são essenciais para otimizar os benefícios terapêuticos. Essa observação reforça a necessidade de terapias combinadas que integrem hipotermia e agonistas de receptores canabinoides, especialmente em neonatos com encefalopatia hipóxico-isquêmica.5,6,7
A ativação seletiva de receptores canabinoides, como CB1 e CB2, tem mostrado resultados promissores em modelos pré-clínicos de lesões cerebrais hipóxico-isquêmicas. O receptor CB1 está associado à redução do dano cerebral por mecanismos que incluem a preservação da barreira hematoencefálica (BHE), diminuição do volume de infartos e modulação da neurotransmissão glutamatérgica. No entanto, a ativação desse receptor pode ter efeitos paradoxais, promovendo tanto respostas neuroprotetoras quanto neurotóxicas, dependendo das condições experimentais e do equilíbrio entre a inibição do glutamato e a liberação de ácido gama-aminobutírico.8
Por outro lado, o receptor CB2 tem atuado como um alvo mais consistente no contexto neuroprotetor devido às suas propriedades anti-inflamatórias. Estudos demonstraram que a ativação de CB2 reduz a neuroinflamação, estabiliza a BHE, modula a produção de citocinas inflamatórias e diminui a adesão de leucócitos aos vasos cerebrais. Esses efeitos são particularmente relevantes na proteção contra danos cerebrais hipóxico-isquêmicos em neonatos, sugerindo que estratégias terapêuticas direcionadas ao CB2 podem oferecer benefícios significativos, especialmente em condições de isquemia cerebral neonatal.9
Além disso, os canabinoides têm demonstrado benefícios adicionais, como a melhora do metabolismo energético em astrócitos e a proteção dessas células gliais contra estímulos citotóxicos e pró-apoptóticos. Estudos também indicam que compostos sintéticos como o WIN55212 promovem a neurogênese e a remielinização após episódios de hipóxia-isquemia, contribuindo para a recuperação funcional do tecido cerebral.10
Um estudo investigou a neuroproteção do canabidiol e da hipotermia em um modelo animal, especificamente em leitões recém-nascidos com lesão cerebral hipóxico-isquêmica (HI). Observou-se que a HI resultou em atividade cerebral deprimida e ativação microglial aumentada. Tanto o CBD isoladamente quanto em combinação com a hipotermia melhoraram significativamente esses efeitos, mas a hipotermia sozinha não demonstrou o mesmo benefício. Embora nem a hipotermia nem o canabidiol isoladamente tenham revertido os aumentos induzidos por HI em Lac/NAA, Glu/NAA, TNFα ou apoptose, a combinação de ambos os tratamentos mostrou um efeito significativo. O tratamento com canabidiol foi bem tolerado pelos leitões.11
As descobertas, obtidas neste modelo animal, sugerem que, embora a administração de canabidiol após hipóxia-isquemia em leitões ofereça alguns efeitos neuroprotetores, a combinação de canabidiol e hipotermia demonstra um efeito aditivo. Essa combinação leva a uma neuroproteção mais completa em comparação com o canabidiol ou a hipotermia administrados isoladamente. Este estudo ressalta o potencial da terapia combinada para otimizar os resultados em casos de lesão cerebral hipóxico-isquêmica neonatal, oferecendo uma abordagem mais abrangente do que as terapias isoladas.11
Outro estudo, realizado em um modelo animal com ratos recém-nascidos, investigou se os efeitos neuroprotetores de curto prazo do canabidiol após hipóxia-isquemia são sustentados a longo prazo. Ratos Wistar foram submetidos a lesão de HI e, subsequentemente, tratados com veículo ou 1 mg/kg de CBD. Os pesquisadores observaram que o CBD modulou a excitotoxicidade cerebral, o estresse oxidativo e a inflamação sete dias após o HI.12
Além disso, o CBD reduziu o volume do infarto cerebral em 17% e diminuiu a extensão do dano histológico. Mais significativamente, 30 dias após o HI, os animais tratados com CBD apresentaram resultados neurocomportamentais semelhantes aos animais controle, indicando uma recuperação funcional duradoura, em contraste com o comprometimento funcional de longa duração observado nos animais não tratados. Os resultados sugerem que o CBD promove uma recuperação funcional mais significativa do que histológica, sem efeitos colaterais aparentes, reforçando o interesse no CBD como um agente neuroprotetor para HI neonatal.12
Os canabinoides apresentam um papel promissor no campo da neuroproteção, especialmente em condições de lesão cerebral hipóxico-isquêmica, devido às suas propriedades anti-inflamatórias, antioxidantes, moduladoras da neurotransmissão e estabilizadoras da barreira hematoencefálica. No entanto, apesar dos avanços significativos em modelos experimentais, a maior parte das evidências disponíveis provém de estudos pré-clínicos, realizados em modelos animais ou in vitro. Portanto, é crucial que esforços futuros sejam direcionados para superar essas barreiras e traduzir os achados pré-clínicos em intervenções terapêuticas seguras e eficazes, oferecendo uma base mais robusta para o uso clínico de canabinoides em condições neurológicas complexas.
Conclusão
Os avanços na compreensão do sistema endocanabinoide e suas interações com os processos neuroinflamatórios e regenerativos têm aberto novas perspectivas para o tratamento da encefalopatia hipóxico-isquêmica neonatal. A aplicação de canabinoides como agentes terapêuticos oferece um potencial significativo para complementar os tratamentos atuais, especialmente em neonatos que não respondem satisfatoriamente à hipotermia terapêutica.
Embora os estudos pré-clínicos tenham apresentado resultados promissores, a tradução desses achados para a prática clínica ainda exige pesquisas adicionais, incluindo ensaios controlados em humanos. A combinação de estratégias como a modulação do sistema endocanabinoide com técnicas já estabelecidas pode representar um avanço crucial para melhorar os desfechos neurológicos desses pacientes.
Manter-se atualizado sobre as opções terapêuticas para Encefalopatia Hipóxico-Isquêmica é essencial para que os médicos ofereçam tratamentos eficazes e baseados em evidências. Nesse cenário, a WeCann se posiciona como uma importante parceira da comunidade médica, fornecendo suporte à tomada de decisões clínicas fundamentadas na ciência. Por meio de recursos técnicos, como o Tratado de Medicina Endocanabinoide, a instituição capacita os profissionais a explorar o potencial terapêutico dos canabinoides no manejo dessa e de outras patologias. Essa abordagem possibilita a integração de terapias de maneira segura, ética e em conformidade com os avanços científicos mais recentes.
Referências
- PIGNATARI, Vinícius Thomaz et al. Neuroproteção na encefalopatia hipóxico-isquêmica neonatal: revisão de literatura. Research, Society and Development, v. 13, n. 5, e0713545695, 2024. Disponível em: http://dx.doi.org/10.33448/rsd-v13i5.45695.
- MONTAGNER, Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- JIE, Xiao; YUE, Zhou; LUQIANG, Sun; HAICHAUN, Wang. Role of integrating cannabinoids and the endocannabinoid system in neonatal hypoxic-ischaemic encephalopathy. Frontiers in Molecular Neuroscience, v. 16, 2023. Disponível em: https://www.frontiersin.org/journals/molecular-neuroscience/articles/10.3389/fnmol.2023.1152167.
- Katona I, Freund TF. Endocannabinoid signaling as a synaptic circuit breaker in neurological disease. Nat Med. 2008 Sep;14(9):923-30. doi: 10.1038/nm.f.1869. Epub 2008 Sep 5. PMID: 18776886.
- Leker, R. R., Gai, N., Mechoulam, R., and Ovadia, H. (2003). Drug-induced hypothermia reduces ischemic damage: Effects of the cannabinoid HU-210. Stroke 34, 2000–2006. doi: 10.1161/01.STR.0000079817.68944.1E
- Lafuente, H., Pazos, M. R., Alvarez, A., Mohammed, N., Santos, M., Arizti, M., et al. (2016). Effects of Cannabidiol and hypothermia on short-term brain damage in new-born piglets after acute hypoxia-ischemia. Front. Neurosci. 10:323. doi: 10.3389/fnins.2016.00323
- Barata, L., Arruza, L., Rodriguez, M. J., Aleo, E., Vierge, E., Criado, E., et al. (2019). Neuroprotection by cannabidiol and hypothermia in a piglet model of newborn hypoxic-ischemic brain damage. Neuropharmacology 146, 1–11. doi: 10.1016/j.neuropharm.2018.11.020
- Chi, O. Z., Barsoum, S., Grayson, J., Hunter, C., Liu, X., and Weiss, H. R. (2012). Effects of cannabinoid receptor agonist WIN 55,212-2 on blood-brain barrier disruption in focal cerebral ischemia in rats. Pharmacology 89, 333–338. doi: 10.1159/000338755
- Rivers, J. R., and Ashton, J. C. (2010). The development of cannabinoid CBII receptor agonists for the treatment of central neuropathies. Cent. Nerv. Syst. Agents Med. Chem. 10, 47–64. doi: 10.2174/187152410790780145
- Zhang, M., Martin, B. R., Adler, M. W., Razdan, R. J., Kong, W., Ganea, D., et al. (2009). Modulation of cannabinoid receptor activation as a neuroprotective strategy for EAE and stroke. J. Neuroimmune Pharmacol. 4, 249–259. doi: 10.1007/s11481-009-9148-4
- Barata L, Arruza L, Rodríguez MJ, Aleo E, Vierge E, Criado E, Sobrino E, Vargas C, Ceprián M, Gutiérrez-Rodríguez A, Hind W, Martínez-Orgado J. Neuroprotection by cannabidiol and hypothermia in a piglet model of newborn hypoxic-ischemic brain damage. Neuropharmacology. 2019 Mar 1;146:1-11. doi: 10.1016/j.neuropharm.2018.11.020. Epub 2018 Nov 20. PMID: 30468796.
- Pazos MR, Cinquina V, Gómez A, Layunta R, Santos M, Fernández-Ruiz J, Martínez-Orgado J. Cannabidiol administration after hypoxia-ischemia to newborn rats reduces long-term brain injury and restores neurobehavioral function. Neuropharmacology. 2012 Oct;63(5):776-83. doi: 10.1016/j.neuropharm.2012.05.034. Epub 2012 May 30. PMID: 22659086.




