A dor neuropática, uma condição crônica e debilitante, afeta milhões de pessoas em todo mundo e está frequentemente associada a danos ou disfunções no sistema nervoso. Caracterizada por sua complexidade e resistência aos tratamentos convencionais, essa forma de dor representa um desafio significativo na prática clínica. Embora antidepressivos e antiepilépticos sejam amplamente prescritos para o manejo dessa condição, eles não foram desenvolvidos especificamente para o tratamento da dor, o que pode limitar sua eficácia. Além disso, esses fármacos, assim como os opioides, frequentemente oferecem alívio insuficiente e estão associados a efeitos colaterais consideráveis, dificultando o manejo adequado dos pacientes.
Nesse contexto, o Δ9-tetraidrocanabinol (THC), um dos principais compostos bioativos da Cannabis sativa, tem se destacado como uma abordagem terapêutica promissora no manejo da dor neuropática crônica. Esse fitocanabinoide apresenta uma capacidade singular de modular os mecanismos fisiopatológicos subjacentes à dor, oferecendo novas perspectivas terapêuticas para pacientes que enfrentam os desafios dessa condição. No post de hoje, vamos explorar como o THC atua no tratamento da dor neuropática crônica, analisando seus mecanismos de ação, evidências científicas e os aspectos clínicos que envolvem sua utilização.
Dor Neuropática Crônica
A dor neuropática crônica é uma condição incapacitante que resulta de lesões ou disfunções no sistema nervoso somatossensorial. Ao contrário de outros tipos de dor, ela não é simplesmente uma resposta a estímulos nocivos, mas uma manifestação patológica de um sistema nervoso comprometido. Essa condição é amplamente reconhecida por sua dificuldade de manejo clínico e por seu impacto profundo na qualidade de vida dos pacientes.
Estima-se que entre 7% e 10% da população adulta global sofra de dor neuropática crônica, o que a torna uma questão significativa de saúde pública. Suas causas variam e incluem desde o uso prolongado de medicamentos neurotóxicos, como os utilizados em quimioterapia, até condições metabólicas, como a neuropatia diabética, doenças neurodegenerativas, como a esclerose múltipla, e traumas mecânicos nos nervos. Independentemente da etiologia, os pacientes frequentemente relatam sintomas característicos, como dor espontânea em queimação, hiperalgesia (resposta amplificada a estímulos dolorosos), alodinia (sensibilidade aumentada a estímulos normalmente inócuos) e dormência.¹
Além da dor física, a condição está associada a prejuízos sociais e econômicos significativos. A dor crônica interfere nas atividades cotidianas, dificulta a interação social e pode comprometer o desempenho no trabalho. Não raramente, o impacto emocional dessa condição leva a um ciclo de sofrimento psicológico, com muitos pacientes desenvolvendo transtornos depressivos como consequência direta do estado doloroso contínuo.
No nível fisiológico, a dor neuropática envolve alterações plásticas complexas tanto no sistema nervoso periférico quanto no central. A medula espinhal, particularmente a região do corno dorsal, desempenha um papel crucial na amplificação e perpetuação desse tipo de dor. Além de integrar informações aferentes sensoriais, o corno dorsal também recebe sinais moduladores provenientes do tronco encefálico por meio das vias descendentes, cuja função é prejudicada na dor neuropática. Nesse contexto, ocorrem alterações neuronais significativas, incluindo sensibilização central, ativação da microglia e um desequilíbrio entre os mecanismos excitatórios e inibitórios do sistema nervoso, contribuindo para a intensificação e manutenção da dor.
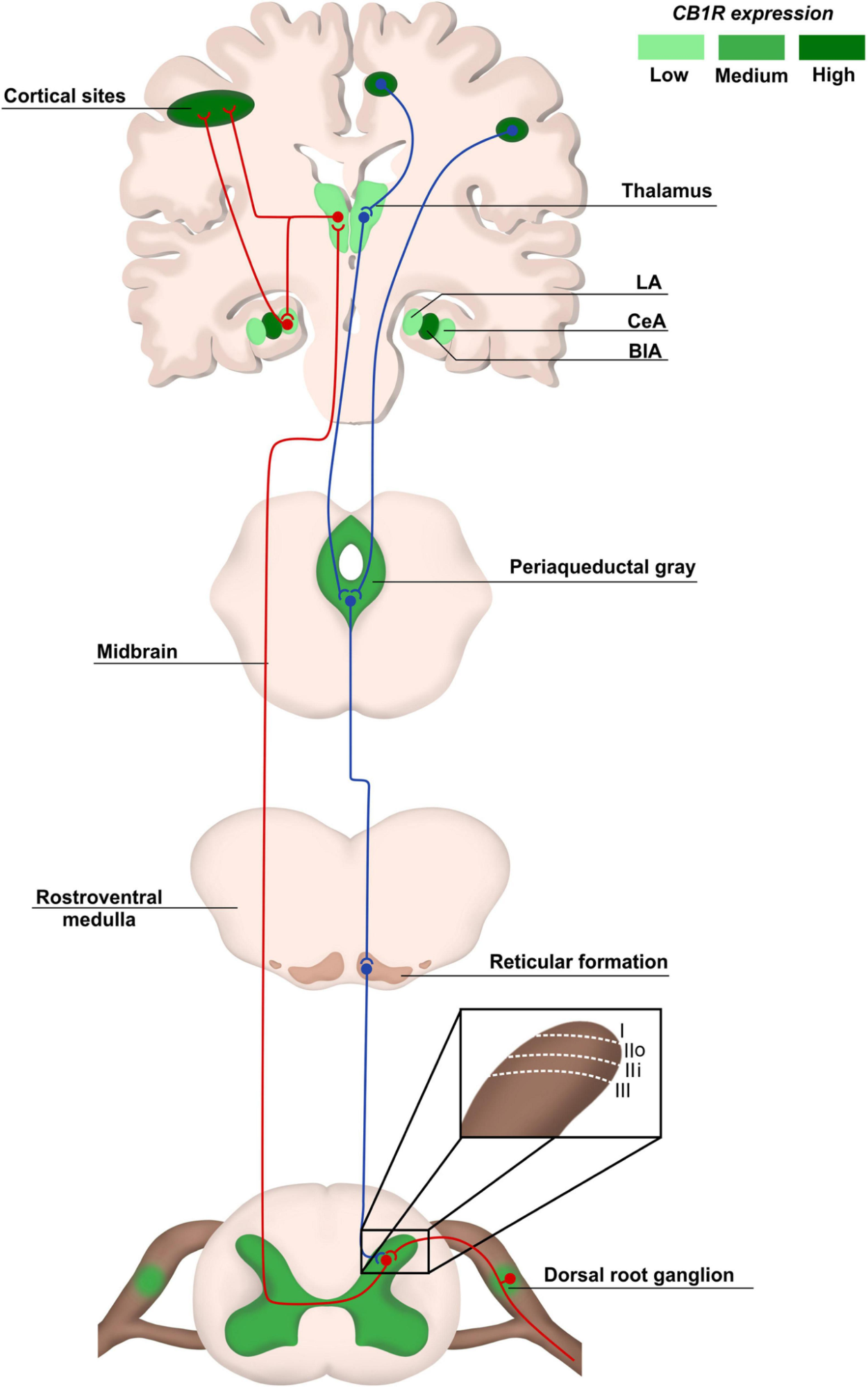
Apesar da diversidade de opções terapêuticas disponíveis, o manejo da dor neuropática crônica representa um desafio significativo devido à complexidade da condição e às limitações das terapias convencionais. Neuromoduladores, como gabapentinoides (gabapentina e pregabalina) e antidepressivos tricíclicos (amitriptilina e nortriptilina), são frequentemente recomendados como tratamentos de primeira linha.
No entanto, sua utilização é acompanhada por limitações substanciais. Os gabapentinoides, por exemplo, apesar de sua eficácia, são frequentemente associados a efeitos colaterais como sonolência, tontura, edema periférico e ganho de peso. Esses efeitos podem impactar a adesão ao tratamento, especialmente em populações mais vulneráveis, como idosos e pacientes com comorbidades. Da mesma forma, os antidepressivos tricíclicos, embora eficazes no controle da dor neuropática, apresentam um perfil de segurança que inclui constipação, ganho de peso e complicações cardiovasculares, como arritmias, que limitam seu uso em pacientes com doenças cardíacas preexistentes.
Outras opções terapêuticas incluem os inibidores da recaptação de serotonina e noradrenalina (IRSN), como duloxetina e venlafaxina, que têm demonstrado eficácia na redução da dor neuropática. Entretanto, esses medicamentos também apresentam efeitos adversos significativos, como náuseas, insônia, hipertensão arterial, disfunção sexual e redução da libido, que podem limitar sua aplicação clínica, especialmente em doses mais altas.
Os opioides, por sua vez, são reservados como última linha de tratamento para a dor neuropática, mas seu uso prolongado levanta preocupações significativas, incluindo tolerância, dependência, depressão respiratória e disfunção cognitiva. A crise dos opioides nos Estados Unidos, marcada por um aumento alarmante de overdoses e mortes, exemplifica os riscos associados a essas drogas, enquanto a dependência e o abuso de opioides seguem uma trajetória crescente em diversas partes do mundo. Esses desafios reforçam a necessidade urgente de novas abordagens terapêuticas mais seguras e eficazes, que conciliem alívio clínico com um perfil de segurança mais favorável.
Nesse contexto, o THC tem se mostrado uma alternativa promissora no tratamento da dor neuropática crônica, oferecendo alívio eficaz sem os diversos efeitos colaterais das terapias convencionais. O THC age nos receptores canabinoides, modulando a dor de maneira mais precisa e eficaz. Além disso, seu uso combinado pode reduzir a necessidade de opioides e melhorar a qualidade do sono, ingestão, estado de ânimo ; e outros sintomas associados à dor, oferecendo um perfil de segurança mais favorável para os pacientes.
Sistema endocanabinoide no processamento da dor
O sistema endocanabinoide (SEC) desempenha um papel fundamental na modulação da dor, atuando tanto nos aspectos fisiológicos quanto nos psicológicos do processamento nociceptivo. Embora grande parte do interesse clínico na cannabis medicinal esteja centrado em seus efeitos analgésicos diretos, seu potencial terapêutico vai além do simples alívio da dor, abrangendo a regulação de mecanismos neurobiológicos e emocionais que influenciam a percepção e a resposta ao sofrimento crônico.
O sistema endocanabinoide (SEC) desempenha um papel central na regulação da dor, agindo de forma dinâmica e sob demanda em diferentes regiões do sistema nervoso periférico (SNP), central (SNC) e imunológico. Suas principais estruturas incluem os receptores canabinoides CB1 e CB2, os endocanabinoides anandamida (AEA) e 2-araquidonoilglicerol (2-AG), e as enzimas FAAH (hidrolase de amidas de ácidos graxos) e MAGL (lipase de monoacilglicerol), responsáveis pela degradação de AEA e 2-AG, respectivamente. O receptor CB1n>, predominante no SNC, está altamente expresso nas sinapses, onde regula a liberação de neurotransmissores, enquanto o receptor CB2 é mais encontrado em células imunológicas e gliais, contribuindo para o controle da inflamação e a modulação da dor crônica de origem inflamatória ou neuropática.²
A modulação do SEC tem se mostrado uma abordagem terapêutica promissora ao influenciar também o sistema imunológico. A inflamação desempenha um papel crucial na patofisiologia da dor neuropática, e a neuroinflamação, que inicialmente serve para promover a regeneração e a cura, pode se tornar um mecanismo desadaptativo, contribuindo para a persistência da dor crônica. Esse processo envolve a ativação de células do sistema imunológico, como macrófagos, linfócitos T, e a liberação de citocinas e quimiocinas. Além disso, a microglia e os astrócitos do SNC são componentes fundamentais na amplificação da dor.³
A regulação dessas células e mediadores inflamatórios, incluindo microRNAs e outros RNAs não codificantes, tem despertado grande interesse como alvos terapêuticos para interromper o ciclo da dor. Distúrbios como síndrome da dorregional complexa, polineuropatias e fibromialgia têm sido intensamente estudados, e a modulação das citocinas, tanto pró-inflamatórias quanto anti-inflamatórias, tem demonstrado efeitos analgésicos significativos em modelos animais. Assim, a interação entre o SEC e o sistema imunológico oferece novas possibilidades para o tratamento da dor neuropática, com o potencial de reduzir a inflamação e, consequentemente, a dor crônica.³
Os canabinoides desempenham um papel fundamental na neuromodulação da dor ao atuar sobre diversos núcleos centrais envolvidos no processamento nociceptivo. A ativação dos receptores CB1 inibe a transmissão ascendente da dor, principalmente no tálamo e no tronco encefálico, reduzindo a propagação dos sinais dolorosos para regiões superiores. Além disso, o sistema endocanabinoide influencia a percepção subjetiva da dor por meio da modulação de circuitos fronto-límbicos, incluindo a amígdala e áreas corticais envolvidas na resposta emocional e cognitiva à dor.
Outro mecanismo essencial é o fortalecimento da via inibitória descendente, mediado pela inibição da liberação de ácido gama-aminobutírico (GABA) na substância cinzenta periaquedutal (PAG) e nos núcleos do rafe, promovendo um efeito antinociceptivo sustentado. A anandamida, um endocanabinoide endógeno, apresenta um efeito bifásico nesse processo: em condições de dor aguda, sua liberação induz analgesia; porém, sob estímulo prolongado ou inflamação periférica, pode ativar o receptor TRPV1 e modular respostas pró nociceptivas. Assim, a interação entre os canabinoides e esses circuitos neurais destaca-se como um mecanismo essencial para o potencial terapêutico da cannabis no manejo da dor crônica.
Na medula espinhal, o SEC exerce um papel crucial na transmissão sináptica em áreas como o corno dorsal e os gânglios da raiz dorsal (DRGs). O CB1 está presente nas fibras sensoriais primárias, enquanto o CB2 aparece nas células imunológicas, ajudando a atenuar respostas inflamatórias locais. Após estímulos nociceptivos, a liberação de neurotransmissores excitatórios ativa receptores glutamatérgicos no terminal pós-sináptico, aumentando o influxo de íons cálcio. Este aumento intracelular de cálcio estimula a produção de endocanabinoides que, ao serem liberados, se ligam aos receptores CB1 no terminal pré-sináptico. Este mecanismo desencadeia a inibição dos canais de cálcio dependentes de voltagem, reduzindo a liberação de neurotransmissores como o glutamato, resultando na modulação da transmissão nociceptiva.4
Além disso, moléculas como a AEA interagem diretamente com os canais TRPV1 (receptor potencial transitório do tipo vaniloide 1), desempenhando um papel adicional na transdução nociceptiva. O TRPV1, amplamente expresso nos neurônios sensoriais do DRG, é ativado por estímulos como calor, ácidos e capsaicina, contribuindo para a sensação de dor. A interação da AEA com o TRPV1 intensifica a sensibilidade à dor em alguns contextos, enquanto pode mitigá-la em outros, dependendo do estado inflamatório do tecido.³
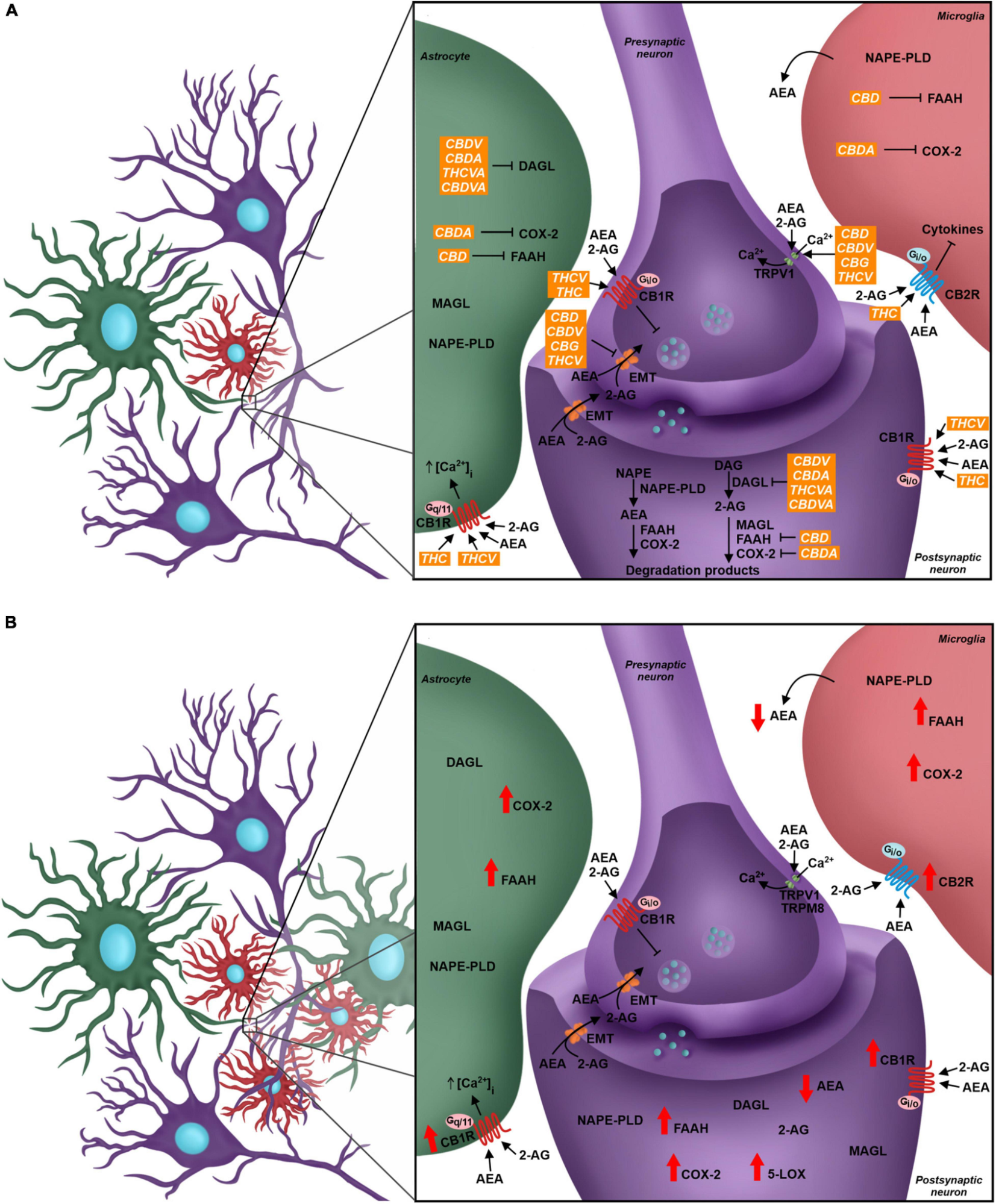
(A) Neurônios, astrócitos e células microgliais têm os componentes SEC, e a sinalização endocanabinoide através de CB1R e CB2R leva a resultados diferentes em cada célula. O neurônio pré-sináptico expressa CB1R, TRPV1, TRPM8 e o transportador de membrana endocanabinoide (EMT). Os receptores são direcionados pelos endocanabinoides (AEA e 2-AG). A modulação CB1R ativa cascatas de sinalização que inibem o influxo intracelular de Ca2+, o que diminui a fusão de vesículas intracelulares com a membrana do neurônio, alterando o fluxo de liberação de neurotransmissores. O neurônio pós-sináptico também apresenta, além dos receptores, todos os elementos do SEC, como as enzimas de síntese AEA e 2-AG, respectivamente NAPE-PLD e DAGL, e as enzimas de degradação, FAAH, MAGL e outras enzimas como COX2.
Em verde: O astrócito participa da sinapse e expressa diferentes elementos do SEC, como enzimas de síntese e degradação de endocanabinoides e receptores canabinoides, onde a ativação de CB1R pode favorecer o influxo de íons Ca2+. A Microglia expressa componentes do SEC; a expressão de CB2R é maior que a de CB1R, e sua modulação está ligada à produção e secreção de diferentes citocinas. Os fitocanabinoides modulam o SEC por meio de muitos alvos. THC e THCV são agonistas do CB1R, enquanto CBD, CBDV, CBG e THCV são agonistas do TRPV1. O transportador EMT é o alvo farmacológico dos fitocanabinoides CBD, CBDV, CBG e THCV. Os fitocanabinoides também atuam sobre a atividade enzimática – o CBD inibe a FAAH, o CBDA inibe a COX-2 e o CBDV, CBDA, THCVA e CBDVA inibem o DAGL.
(B) No cenário da Dor Neuropática, há reatividade glial, levando ao aumento de astrócitos e microglias próximos aos neurônios, principalmente na medula espinhal dorsal. O SEC é modulado e os níveis de expressão de seus componentes mudam. Há uma maior expressão de CB1R e CB2R em neurônios e células gliais. Enzimas como FAAH, COX-2 e 5-LOX também aumentam sua expressão e, como resultado, há diminuição dos níveis de AEA e aumento de mediadores pró-inflamatórios.
O THC exerce sua ação analgésica por meio de múltiplos mecanismos, que envolvem tanto a modulação da nocicepção espinal quanto a influência sobre o processamento central da dor. A ativação dos receptores CB1 pelo THC em estruturas supraespinhais estimula vias descendentes serotoninérgicas e noradrenérgicas moduladoras da dor, potencializando a ação de receptores como 5-HT7, 5-HT2A e α2-adrenérgicos na medula espinhal, resultando em efeito antinociceptivo. Além da ação direta na transmissão da dor, o THC também interfere na experiência subjetiva do desconforto doloroso ao modular a atividade da amígdala, região crucial na resposta emocional à dor.
A dor é não apenas uma experiência sensorial, mas também cognitiva e emocional, com diferentes áreas do cérebro envolvidas na sua percepção e avaliação afetiva. O THC parece atuar de forma preferencial sobre as qualidades afetivas da dor, aliviando o desconforto sem necessariamente reduzir a intensidade da dor. Esse mecanismo central de ação pode ser especialmente relevante para a analgesia canabinoide, como evidenciado por estudos de ressonância magnética funcional, que demonstraram que o THC reduz a conectividade funcional entre o córtex cingulado anterior, a amígdala e as áreas sensório-motoras, impactando diretamente a resposta emocional e afetiva à dor.5
A redução da atividade na amígdala e a consequente diminuição da conectividade sensório-límbica estão correlacionadas com o alívio do desconforto, mas não da intensidade da dor, sugerindo um efeito dissociativo da cannabis que pode ser crucial para o manejo da dor crônica. Esses dados reforçam a ideia de que o THC pode atenuar não apenas a percepção sensorial da dor, mas também a resposta emocional associada a ela, oferecendo uma abordagem terapêutica mais abrangente para pacientes com dor neuropática crônica.5
A ativação dos receptores CB2 desempenha um papel crucial na modulação periférica da dor ao estimular a liberação de β-endorfina pelos queratinócitos, promovendo a inibição da nocicepção nos neurônios aferentes primários. Embora o mecanismo exato ainda não esteja totalmente elucidado, evidências sugerem que o CB2 se acopla à proteína Gi/o, levando à ativação da via de sinalização Gβγ-MAPK-Ca²⁺. Esse processo resulta no aumento do cálcio intracelular, um evento essencial para a liberação de β-endorfina.6
Estudos demonstraram que a inibição da quinase MAPK bloqueia esse efeito analgésico, reforçando a importância dessa via na analgesia mediada pelo CB2. Em modelos de dor inflamatória, a ativação periférica do CB2 mostrou-se eficaz na redução da nocicepção, destacando seu potencial terapêutico como alvo para novas abordagens no tratamento da dor crônica. Esses achados sugerem que a modulação do CB2 pode representar uma estratégia promissora para o alívio da dor, especialmente em contextos onde a ativação dos sistemas opioide e canabinoide periféricos pode ser explorada de maneira sinérgica.6
O THC modula a experiência da dor não apenas por meio de sua ação analgésica direta, mas também ao alterar a conectividade funcional entre regiões cerebrais envolvidas no processamento cognitivo da dor. Estudos de neuroimagem demonstram que a administração de THC reduz a conectividade entre o córtex cingulado anterior (ACC) e o córtex sensório-motor, uma modificação que está diretamente correlacionada à diminuição da dor percebida pelos pacientes. Além disso, análises baseadas na teoria dos grafos indicam que o THC reduz a conectividade de redes neurais em áreas como o córtex pré-frontal dorsolateral (DLPFC), estrutura envolvida na modulação cognitiva da dor.7
Esse desacoplamento funcional pode explicar por que os pacientes frequentemente relatam uma redução no desconforto e no impacto emocional da dor, mesmo quando a intensidade objetiva da sensação dolorosa não se altera significativamente. Assim, os efeitos do THC vão além da simples inibição da transmissão nociceptiva, influenciando também a percepção subjetiva e a resposta emocional à dor, o que pode ser particularmente benéfico para pacientes com dor crônica.7
O SEC emerge como uma rede multifacetada e essencial na modulação da dor, especialmente em contextos de dor neuropática. Sua atuação envolve mecanismos complexos e dinâmicos, que englobam desde a regulação da liberação de neurotransmissores nos neurônios até a mediação de respostas inflamatórias por células gliais. A interação entre receptores canabinoides, endocanabinoides e enzimas reguladoras oferece uma base robusta para a compreensão dos processos nociceptivos, seja por meio da modulação do SEC ou do processamento cognitivo e emocional da dor.
A introdução de fitocanabinoides, como o THC, evidencia o significativo potencial terapêutico dessa classe de compostos. Como agonista parcial dos receptores CB1R e CB2R do sistema endocanabinoide, o THC desempenha um papel essencial na modulação da dor neuropática. Ao se ligar ao CB1R, predominante no sistema nervoso central, o THC reduz a liberação de neurotransmissores excitatórios, atenuando a percepção dolorosa. Paralelamente, sua interação com o CB2R, presente em células gliais e imunológicas, contribui para o controle da inflamação neurogênica, um fator chave na amplificação da dor neuropática. Assim, os avanços no entendimento do sistema endocanabinoide e sua modulação abrem novas perspectivas para o manejo da dor crônica.
Para saber mais sobre o papel do Canabidiol na Dor Neuropática acesse: Canabidiol no tratamento da Dor Neuropática – WeCann Academy
Evidências Científicas
O uso de THC no tratamento da dor neuropática tem sido amplamente estudado. Pesquisas pré-clínicas e clínicas demonstram que o THC desempenha um papel significativo na modulação da dor neuropática, especialmente quando combinado com outros canabinoides, como o canabidiol (CBD).
Estudos demonstram que os extratos integrais de Cannabis sativa, como o Sativex® — um spray bucal com proporção equilibrada de 1:1 de THC e CBD —, têm mostrado eficácia significativa no manejo da dor neuropática, superando o desempenho de formas sintéticas isoladas de THC, como o dronabinol. Um exemplo relevante é o estudo conduzido por Nurmikko et al. (2007), que avaliou 125 pacientes com dor neuropática periférica em um ensaio clínico randomizado, duplo-cego e controlado por placebo.4
Nesse estudo, os pacientes foram divididos em dois grupos: um recebeu o Sativex®, enquanto o outro foi tratado com placebo. Durante cinco semanas, os pesquisadores monitoraram a intensidade da dor, medida em uma escala analógica visual (EAV), além de sintomas associados, como alodinia dinâmica e pontual, e a qualidade do sono.8
Os resultados indicaram que o grupo tratado com Sativex® apresentou uma redução significativa na intensidade da dor neuropática em comparação ao grupo placebo, evidenciando a eficácia analgésica do medicamento. Além disso, os pacientes tratados relataram melhorias substanciais na alodinia dinâmica e pontual, problemas frequentemente associados à dor neuropática. Importante destacar que não houve relatos de efeitos adversos graves entre os participantes que utilizaram o Sativex®. Os poucos efeitos colaterais observados, como tontura e fadiga, foram leves e manejáveis, sem impactar a continuidade do tratamento.8
Outro estudo notável foi realizado por Ueberall et al. (2019), investigando os efeitos a longo prazo do Sativex® em um cenário clínico real. A pesquisa incluiu pacientes com dor neuropática crônica que não responderam adequadamente a tratamentos convencionais. Ao longo de 12 semanas, os participantes receberam o spray bucal Sativex® em uma frequência de 8 a 12 vezes ao dia, resultando em uma dose diária média de 22 mg de THC e 20 mg de CBD.9
Os resultados foram expressivos: 67,5% dos pacientes relataram uma redução de pelo menos 50% na intensidade da dor após o período de intervenção. Além disso, houve uma melhora significativa no bem-estar geral dos participantes, medida por fatores como redução de estresse e ansiedade, segundo o questionário Aggregated 9-Factor Symptom Relief (ASR-9). Adicionalmente, o estudo destacou que o uso do Sativex® permitiu a diminuição ou até mesmo a interrupção do uso de opioides em muitos pacientes, representando um avanço importante na abordagem de dores neuropáticas.9
A via de administração do THC é fundamental para sua eficácia e segurança terapêutica. A inalação, por exemplo, se destaca por proporcionar ação rápida e permitir o controle preciso da dosagem. O estudo de Almog et al. (2020) investigou o uso do inalador dosimetrado Syqe®, uma tecnologia inovadora que permite a administração de doses exatas de THC. Esse dispositivo é particularmente interessante por sua precisão, permitindo aos pacientes receberem doses extremamente controladas e adequadas à sua necessidade. No estudo, doses tão baixas quanto 1 mg de THC foram suficientes para promover uma analgesia eficaz em pacientes com dor crônica. Essa dosagem reduzida contribuiu para minimizar significativamente o risco de efeitos adversos, que são comuns com tratamentos que envolvem doses mais altas de THC.10
As evidências de revisões sistemáticas e metanálises têm reforçado o papel terapêutico do THC no manejo da dor neuropática. Uma das revisões relevantes é a de Darkovska-Serafmovska et al. (2018), que analisou a eficácia do nabiximols, uma formulação combinando THC e CBD em proporção 1:1. O estudo revelou que, em média, dez pulverizações diárias de nabiximols (equivalente a cerca de 27 mg de THC e 25 mg de CBD) proporcionaram um controle eficaz da dor crônica em paciente com dor neuropática e outras condições desafiadoras, como artrite reumatoide e câncer.11
Uma revisão sistemática com meta-análise avaliou o impacto de diferentes formulações canabinoides no alívio da dor neuropática. Os resultados demonstraram que o THC, isolado ou em combinação com CBD, promoveu uma redução estatisticamente significativa na intensidade da dor em comparação com o placebo. A redução foi de -6,624 unidades (P < 0,001) para a formulação combinada THC/CBD, -8,681 unidades (P < 0,001) para o THC isolado e -6,0 unidades (P = 0,008) para o dronabinol, em uma escala de 0 a 100.12
Além disso, pacientes que utilizaram THC/CBD tiveram 1,756 vezes mais chances de alcançar uma redução de 30% na dor (P = 0,008) e 1,422 vezes mais chances de atingir uma redução de 50% (P = 0,37) em comparação ao placebo. Da mesma forma, aqueles tratados com THC isolado tiveram uma melhora 21% maior na intensidade da dor (P = 0,005) e foram 1,855 vezes mais propensos a obter uma redução de 30% na dor (P < 0,001). Esses achados reforçam o potencial terapêutico do THC, especialmente quando combinado ao CBD, no tratamento da dor neuropática crônica, sugerindo sua relevância como alternativa aos tratamentos convencionais.12
Outro estudo relevante, conduzido por Portenoy et al. (2012), destacou a eficácia de doses menores de nabiximols, especificamente quatro pulverizações diárias, equivalentes a 10,8 mg de THC e 10 mg de CBD, no tratamento da dor neuropática. Os resultados demonstraram que mesmo essas doses reduzidas proporcionaram alívio significativo da dor crônica, com menor incidência de efeitos adversos em comparação a dosagens mais elevadas. Esses achados ressaltam que doses menores de THC podem oferecer benefícios terapêuticos consideráveis, equilibrando eficácia e segurança.13
As evidências científicas reforçam que o THC representa uma opção eficaz para o tratamento da dor neuropática. Além de sua capacidade de aliviar a dor, tem demonstrado benefícios adicionais, como a melhoria da qualidade de vida dos pacientes e a redução da dependência de opioides. Esses resultados destacam o potencial desse fitocanabinoide como uma alternativa terapêutica inovadora e promissora no manejo da dor neuropática.
Conclusão
O Δ9-THC representa uma abordagem terapêutica inovadora e promissora para o manejo da dor neuropática, destacando-se por sua capacidade de modular os mecanismos fisiopatológicos subjacentes a essa condição. Sua interação com o sistema endocanabinoide proporciona um alívio eficaz da dor, aliado a um perfil de segurança potencialmente superior em relação às terapias convencionais. Além disso, oferece benefícios significativos, como a redução da dependência de opioides e a melhoria da qualidade de vida dos pacientes.
O uso da cannabis medicinal tem ganhado destaque na medicina contemporânea, oferecendo novas perspectivas para o tratamento de diversas condições clínicas. Contudo, apesar do crescente volume de evidências científicas, muitos médicos ainda enfrentam desafios significativos para incorporar essa terapia em sua prática clínica. A falta de formação específica, o desconhecimento sobre os mecanismos de ação dos canabinoides e as nuances legais relacionadas ao seu uso podem limitar a capacidade dos profissionais de explorar todo o potencial terapêutico da cannabis.
Nesse cenário, a Comunidade WeCann surge como uma aliada estratégica. Mais do que um espaço de aprendizado, a WeCann é uma plataforma de transformação, conectando médicos e acadêmicos a um universo de conhecimento especializado. Combinando educação, troca de experiências e acesso a uma rede global de especialistas, a WeCann se propõe a preencher lacunas importantes na formação médica, capacitando profissionais a utilizarem a cannabis de forma segura, eficaz e fundamentada na ciência.
Além disso, a WeCann se destaca pela sua estrutura educativa, oferecendo ferramentas práticas e recursos de fácil acesso. As “WeCann Talks” e os “WeCann Rounds” proporcionam discussões dinâmicas sobre os mais recentes protocolos de tratamento, permitindo que os médicos compartilhem insights e tirem dúvidas diretamente com especialistas de renome. O aplicativo da WeCann garante que a educação e o networking possam ser acessados a qualquer hora e de qualquer lugar, promovendo uma verdadeira revolução no ensino médico. Ao fazer parte dessa comunidade, os médicos não só aprimoram suas habilidades terapêuticas, mas também garantem que seus pacientes recebam cuidados mais personalizados e eficazes.
Referências
- Mücke M, Phillips T, Radbruch L, Petzke F, Häuser W. Cannabis-based medicines for chronic neuropathic pain in adults. Cochrane Database Syst Rev. 2018 Mar 7;3(3):CD012182. doi: 10.1002/14651858.CD012182.pub2. PMID: 29513392; PMCID: PMC6494210.
- MONTAGNER, Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Sommer, Claudiaa,*; Leinders, Mathiasa,b; Üçeyler, Nurcana. Inflamação na fisiopatologia da dor neuropática. DOR 159(3):p 595-602, março de 2018. | DOI: 10.1097/j.pain.00000000000001122
- CAMPOS, Raquel Maria P.; AGUIAR, Andrey F. L.; PAES-COLLI, Yolanda; TRINDADE, Priscila Martins Pinheiro; FERREIRA, Bruna K.; DE MELO REIS, Ricardo A.; SAMPAIO, Luzia S. Cannabinoid therapeutics in chronic neuropathic pain: from animal research to human treatment. Frontiers in Physiology, v. 12, 2021. Disponível em: https://www.frontiersin.org/journals/physiology/articles/10.3389/fphys.2021.785176. DOI: 10.3389/fphys.2021.785176.
- Lee MC, Ploner M, Wiech K, Bingel U, Wanigasekera V, Brooks J, Menon DK, Tracey I Amygdala activity contributes to the dissociative effect of cannabis on pain perception. Pain. 2013;154(1):124-34.
- Gao, F., Zhang, LH., Su, TF. et al. Signaling Mechanism of Cannabinoid Receptor-2 Activation-Induced β-Endorphin Release. Mol Neurobiol 53, 3616–3625 (2016). https://doi.org/10.1007/s12035-015-9291-2
- WEIZMAN, Libat et al. Cannabis analgesia in chronic neuropathic pain is associated with altered brain connectivity. Neurology, v. 91, n. 14, p. e1285-e1294, 2018. DOI: 10.1212/WNL.0000000000006293.
- Nurmikko, T. J., Serpell, M. G., Hoggart, B., Toomey, P. J., Morlion, B. J., and Haines, D. (2007). Sativex successfully treats neuropathic pain characterised by allodynia: a randomised, double-blind, placebo-controlled clinical trial. Pain 133, 210–220. doi: 10.1016/j.pain.2007.08.028
- Ueberall, M. A., Essner, U., and Mueller-Schwefe, G. H. (2019). Effectiveness and tolerability of THC:CBD oromucosal spray as add-on measure in patients with severe chronic pain: analysis of 12-week open-label real-world data provided by the German Pain e-Registry. J. Pain Res. 12, 1577–1604. doi: 10.2147/jpr.S192174
- Almog, S. et al. The pharmacokinetics, efficacy, and safety of a novel selective-dose cannabis inhaler in patients with chronic pain: A randomnized, double-blinded, placebo-controlled trial. Eur. J, Pain 24 1505-1516 (2020).
- Darkovska-Serafimovska, M. et al. Pharmacotherapeutic considerations for use of cannabinoids to relieve pain in patients with malignant diseases.J. Pain Res. Volume 1 1, 837-842 (2018).
- Sainsbury B, Bloxham J, Pour MH, Padilla M, Enciso R. Efficacy of cannabis-based medications compared to placebo for the treatment of chronic neuropathic pain: a systematic review with meta-analysis. J Dent Anesth Pain Med. 2021 Dec;21(6):479-506. doi: 10.17245/jdapm.2021.21.6.479. Epub 2021 Nov 26. PMID: 34909469; PMCID: PMC8637910.
- Portenoy, R.K. et al. Nabiximols for Opioid-Treated Cancer Patients With Poorly-Controlled Chronic Pain: A Randomized, Placebo-Controlled, Graded-Dose Trial. J. Pain 13, 438-449 (2012).




