A mucosite oral representa um desafio significativo no tratamento de pacientes submetidos a terapias oncológicas, particularmente quimioterapia e radioterapia. Esta condição dolorosa e debilitante afeta a mucosa bucal, causando inflamação, úlceras e desconforto intenso que pode comprometer severamente a qualidade de vida dos pacientes.
Nas últimas décadas, os canabinoides têm emergido como uma potencial alternativa terapêutica para o manejo dos sintomas associados à mucosite oral, despertando o interesse da comunidade científica. No post de hoje, vamos explorar como os canabinoides podem atuar no tratamento da mucosite oral.
Veja nessa postagem
Compreendendo a Mucosite Oral
A mucosite oral é uma complicação devastadora e frequente dos tratamentos oncológicos, caracterizada por inflamação e ulceração da mucosa bucal, que surge como consequência direta da radioterapia e quimioterapia. Mais do que uma simples lesão superficial, representa um processo biomolecular intrincado que pode comprometer significativamente o tratamento do câncer e a qualidade de vida do paciente.¹
A compreensão da mucosite oral tem evoluído significativamente nas últimas décadas, transformando-se de uma perspectiva simplista de dano tecidual para um complexo fenômeno molecular com profundas implicações clínicas. Historicamente, acreditava-se que a mucosite era resultado exclusivo da agressão direta de agentes antineoplásicos às células proliferativas da mucosa, resultando em morte celular e comprometimento da renovação mucosa.
Atualmente, os dados epidemiológicos são eloquentes: aproximadamente 60% dos pacientes submetidos à radioterapia isolada e impressionantes 90% daqueles em tratamento combinado de radio e quimioterapia desenvolvem mucosite oral severa. Essa condição não representa apenas um desafio terapêutico, mas uma complexa cascata de eventos biológicos que compromete significativamente o tratamento oncológico.
A patobiologia da mucosite oral pode ser compreendida como uma progressão dinâmica em cinco fases fundamentais. A fase inicial, denominada de iniciação, ocorre imediatamente após a exposição aos tratamentos, caracterizando-se pela produção de radicais livres de oxigênio que causam danos diretos ao DNA das células basais do epitélio. Na fase seguinte, de regulação, observa-se a ativação de fatores de transcrição como NF-KB, responsáveis pela elevação de citocinas circulantes e produção de injúrias no epitélio, endotélio e tecido conjuntivo.¹
A progressão para a fase de amplificação marca um momento crítico, onde múltiplos mediadores inflamatórios são ativados simultaneamente. O TNF-α se destaca como um potente ativador, propagando mudanças pró-inflamatórias. A fase de ulceração representa o ponto culminante deste processo, com exposição de terminações nervosas, colonização microbiana e estímulo adicional à resposta inflamatória.¹
A dimensão microbiológica da mucosite é particularmente fascinante. Microrganismos como Streptococcus mitis, Streptococcus viridans e Porphyromonas sp. não são meros espectadores, mas protagonistas ativos. A interação microbiana desencadeia uma complexa cascata imunológica, com ativação de citocinas como TNF, IL-6 e IL-1. Os lipopolissacarídeos microbianos transpassam células epiteliais, interagindo com macrófagos e alterando a permeabilidade vascular, recrutando células inflamatórias e acumulando produtos tóxicos.¹
As consequências clínicas da mucosite oral vão muito além do dano local. Essa condição representa um fator crítico de interrupção terapêutica, comprometendo o controle tumoral e elevando significativamente a morbimortalidade. Em muitos casos, a dor intensa e debilitante exige o uso de opioides, o que não apenas aumenta o risco de efeitos adversos, mas também predispõe os pacientes a infecções graves, como aquelas causadas por Streptococcus viridans.
As estratégias terapêuticas convencionais incluem uma abordagem multifacetada, envolvendo o uso de gluconato de clorexidina, soluções salinas, combinações antibióticas e antifúngicas, sucralfato e laser de baixa potência. Embora essas intervenções tenham algum grau de eficácia na redução da inflamação e no alívio sintomático, elas frequentemente falham em modificar o curso da doença de maneira significativa. Além disso, muitas dessas abordagens apresentam limitações importantes, como efeitos adversos, custo elevado e eficácia variável entre os pacientes.
A compreensão da mucosite oral evoluiu, portanto, de uma visão simplista de dano epitelial para um fenômeno molecular altamente complexo, no qual processos inflamatórios exacerbados e mecanismos de expressão gênica desempenham papeis centrais. Essa nova perspectiva abre caminho para abordagens terapêuticas inovadoras, entre elas, o uso dos canabinoides.
Evidências emergentes sugerem que os canabinoides possuem propriedades anti-inflamatórias, analgésicas e imunomoduladoras que podem atuar nos processos fisiopatológicos da mucosite oral. Além de reduzir a dor sem os riscos associados aos opioides, os canabinoides apresentam potencial para modular a resposta inflamatória e promover a regeneração tecidual. Essas características os tornam uma promissora alternativa terapêutica, capaz não apenas de aliviar os sintomas, mas de interferir na cascata inflamatória subjacente, oferecendo uma abordagem mais eficaz e menos invasiva para o manejo da mucosite oral.
Canabinoides: Mecanismos de ação e potencial terapêutico na mucosa oral
Os canabinoides constituem uma classe diversificada de compostos químicos derivados da planta Cannabis sativa, destacando-se por seu amplo espectro de propriedades terapêuticas. No contexto medicinal, dois fitocanabinoiades principais merecem atenção especial: o delta-9-tetrahidrocanabinol (THC), responsável pelos efeitos psicotrópicos, e o canabidiol (CBD), desprovido de efeito psicomimético significativo.
O sistema endocanabinoide (SEC) representa uma complexa rede de sinalização neuromoduladora presente no organismo humano, composta por receptores canabinoides (principalmente CB1 e CB2), canabinoides endógenos (como anandamida e 2-araquidonoilglicerol) e enzimas responsáveis pela síntese e degradação desses compostos. Este sistema desempenha papeis cruciais na homeostase corporal, influenciando processos fisiológicos como modulação da resposta inflamatória e imunológica, regulação da percepção da dor, controle da proliferação e diferenciação celular, e manutenção da integridade tecidual.
Para saber mais sobre o Sistema Endocanabinoide acesse:O que é o Sistema Endocanabinoide?
A mucosa oral constitui um importante sítio de interação com canabinoides exógenos, tornando essencial a compreensão da distribuição e função dos receptores canabinoides neste tecido. Evidências científicas demonstram a presença de receptores CB1 e CB2 em diversos componentes da cavidade oral.
No epitélio da mucosa oral, receptores CB1 e CB2 foram identificados nas células epiteliais, exercendo funções antagônicas: enquanto receptores CB2 estimulam a proliferação e diferenciação de queratinócitos epiteliais, os receptores CB1 apresentam efeito inibitório sobre estes processos. Na lâmina própria, ambos os receptores CB1 e CB2 foram detectados no tecido conjuntivo subjacente ao epitélio, embora os dados sobre sua distribuição específica e funções neste compartimento ainda sejam limitados.²
A expressão de receptores CB1 e CB2 nas células epiteliais e papilas gustativas da língua apresenta regulação dependente do estado fisiopatológico. Em condições como a síndrome da boca ardente, observa-se diminuição na expressão de CB1 e aumento na expressão de CB2. Em carcinoma espinocelular de língua, ambos os receptores apresentam expressão aumentada. Na polpa dentária, receptores CB1 foram identificados nas fibras nervosas simpáticas e na interface polpa-dentina, sugerindo potencial aplicação terapêutica contra dor dentária. Em odontoblastos humanos, estes receptores respondem a desafios imunológicos, promovendo a formação de dentina secundária através da modulação do influxo de cálcio.²
Nas glândulas salivares maiores, receptores CB1 são expressos predominantemente nas células do ducto estriado, enquanto receptores CB2 localizam-se nas células acinares e mioepiteliais. Esta distribuição específica confere capacidade de modulação da secreção salivar pelos canabinoides. A diferenciação na distribuição dos receptores parece ser regulada pelo tipo e quantidade de alimento, demonstrando a plasticidade do sistema endocanabinoide na cavidade oral.²
A mucosite oral, caracterizada por inflamação e ulceração da mucosa bucal, representa um efeito colateral frequente e debilitante de terapias oncológicas. Os canabinoides apresentam múltiplos mecanismos de ação que podem beneficiar pacientes acometidos por esta condição. A ação anti-inflamatória ocorre principalmente através da ativação dos receptores CB2 predominantes em células do sistema imune, inibindo a produção de citocinas pró-inflamatórias (TNF-α, IL-1β, IL-6) e promovendo a liberação de mediadores anti-inflamatórios.²
Adicionalmente, suprimem a ativação do fator nuclear kappa B (NF-κB), reduzindo a cascata inflamatória associada à mucosite, e modulando a atividade de células imunes como macrófagos e neutrófilos, limitando o dano tecidual secundário à resposta inflamatória exacerbada.²
Os efeitos analgésicos dos canabinoides são mediados pela ativação de receptores CB1 nas terminações nervosas da mucosa oral, suprimindo a transmissão nociceptiva e reduzindo a sensibilidade à dor. A interação com canais TRPV1 (receptores vaniloides) contribui para o efeito analgésico, particularmente relevante nas lesões ulcerativas dolorosas da mucosite. Há também modulação da liberação de neurotransmissores envolvidos na sinalização da dor no sistema nervoso central e periférico.²
Na promoção da cicatrização tecidual, os canabinoides estimulam a proliferação e migração de queratinócitos através da ativação de receptores CB2, acelerando o fechamento de lesões epiteliais. Além disso, promovem a angiogênese controlada, essencial para o processo de reparo tecidual, e modulam a atividade de fibroblastos e a deposição de matriz extracelular, contribuindo para a restauração da integridade da mucosa. Nos odontoblastos, a sinalização via receptores CB1 facilita a formação de dentina secundária através da modulação do canal trocador Na⁺-Ca²⁺ e canais TRPV1.²
No aspecto da proteção antioxidante, os canabinoides, particularmente o CBD, exibem propriedades antioxidantes intrínsecas, neutralizando radicais livres gerados durante o estresse oxidativo associado à quimioterapia e radioterapia. Induzem a expressão de enzimas antioxidantes endógenas como superóxido dismutase e catalase, reforçando os mecanismos de defesa celular. Também, reduzem a peroxidação lipídica e o dano oxidativo a proteínas e DNA, preservando a viabilidade celular.²
Este conjunto de mecanismos sugere que os canabinoides representam uma promissora abordagem multimodal para o manejo da mucosite oral, atuando simultaneamente na redução da inflamação, alívio da dor, aceleração da cicatrização e proteção contra danos oxidativos. A compreensão detalhada da distribuição dos receptores canabinoides na mucosa oral e dos mecanismos moleculares subjacentes proporciona a base científica para o desenvolvimento de novas estratégias terapêuticas baseadas em canabinoides para o tratamento da mucosite oral e outras condições inflamatórias da cavidade bucal.
Evidências Científicas
As evidências científicas sobre o potencial terapêutico dos canabinoides no tratamento da mucosite oral têm despertado interesse na comunidade científica e odontológica. Diversos estudos pré-clínicos e clínicos têm explorado os mecanismos de ação e a eficácia desses compostos no manejo desta condição debilitante, que frequentemente acomete pacientes submetidos a tratamentos oncológicos.
O canabidiol, em particular, demonstrou propriedades anti-inflamatórias, antioxidantes e analgésicas que o tornam uma alternativa promissora para a prevenção e tratamento da mucosite oral. Pesquisas sugerem que o CBD pode reduzir significativamente o processo inflamatório e a gravidade das lesões ulcerativas características desta condição. A combinação destas propriedades terapêuticas confere ao CBD uma ação potencialmente mais efetiva que antioxidantes convencionais, promovendo alterações favoráveis no epitélio oral lesionado.
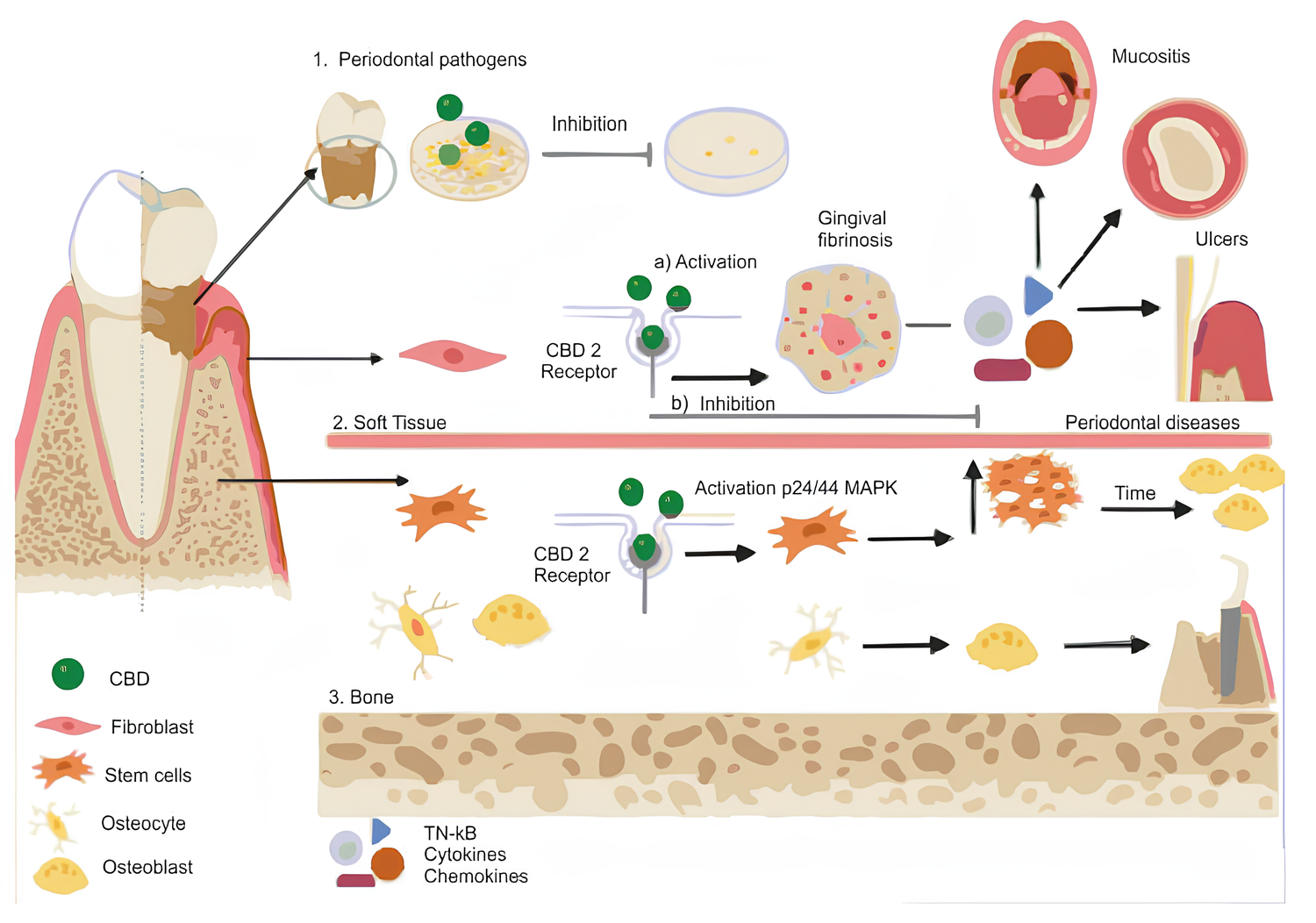
- O CBD pode reduzir colônias de patógenos periodontais, mostrando propriedades antimicrobianas.
- Em tecidos moles, o CBD pode ativar os receptores CB2 em fibroblastos e levar à fibrose gengival, aumentando a produção de fibroblastos gengivais por meio da estimulação de fatores de crescimento e diminuição das metaloproteinases da matriz. Simultaneamente, o CBD pode inibir ou modular a produção de citocinas, quimiocinas e fatores de crescimento pró-inflamatórios, interferindo na migração de macrófagos e neutrófilos, gerando potenciais produtos anti-inflamatórios, antioxidantes e analgésicos. Os tratamentos potenciais incluem úlceras, mucosite e como adjuvante em doenças periodontais.
- No osso, o CBD pode promover a estimulação de células mesenquimais por meio de proteínas quinases ativadas por mitógenos p42/44 (MAPK) em direção ao local da lesão e sua diferenciação em osteoblastos.
Lowe e colaboradores indicaram que o CBD pode ser benéfico no tratamento da mucosite oral resultante de quimioterapia e radiação relacionadas ao câncer. Embora as evidências não sejam ainda extensas, as propriedades antioxidantes do CBD sugerem que ele pode ajudar a controlar o estresse oxidativo associado à mucosite oral. A capacidade do CBD de modular os receptores canabinoides e exercer efeitos anti-inflamatórios aponta para uma potencial nova abordagem terapêutica para esta condição.³
Em um estudo particularmente relevante, Qi X e colaboradores demonstraram potencial terapêutico significativo do CBD no tratamento de úlceras orais, condição que compartilha mecanismos fisiopatológicos com a mucosite oral. A aplicação tópica de CBD em úlceras induzidas experimentalmente, em concentrações de 1 mg/mL e 10 mg/mL, resultou em redução da inflamação, alívio da dor e cicatrização acelerada, com a dose mais alta associada a melhores efeitos terapêuticos.4
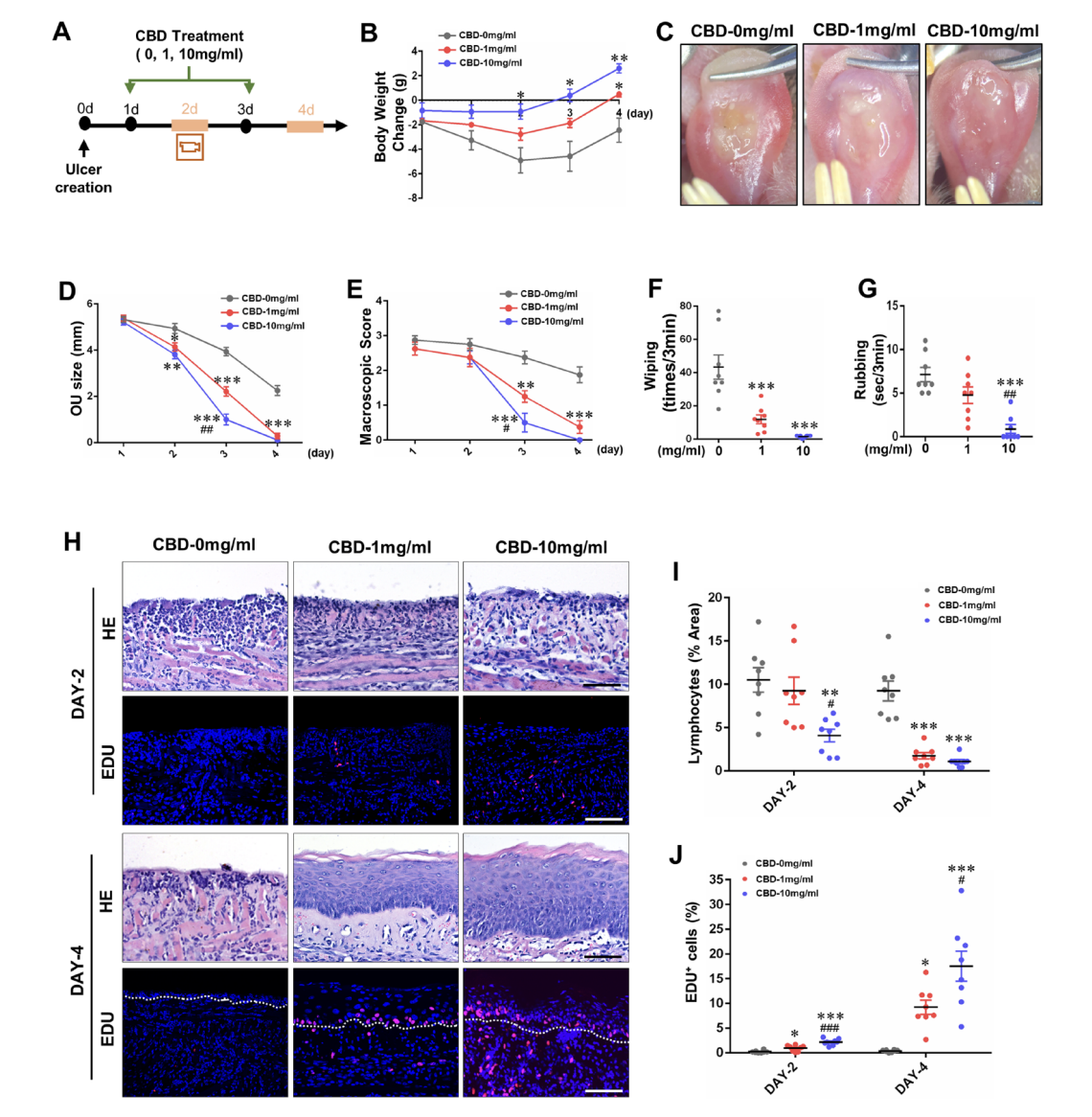
- (A) Ilustração esquemática da úlcera oral induzida por ácido e do protocolo de tratamento com CBD.
- (B) Alteração do peso corporal após a estimulação ácida.
- (C) Imagens representativas das línguas no dia 3.
- (D) Tamanhos das úlceras na língua.
- (E) Escores macroscópicos que avaliam a gravidade clínica das úlceras orais.
- (F) Número de limpezas faciais
- (G) tempo de fricção durante um bloco de 3 minutos após 1 dia de administração de CBD em camundongos com úlcera oral induzida por ácido.
- (H) Coloração de hematoxilina e eosina (HE) e imunocoloração dos tecidos ulcerados da língua de camundongos tratados com CBD e grupos de veículos nos dias 2 e 4. Escala, 50μm.
- (I, J) Quantificação de células inflamatórias infiltradas e células com coloração positiva para imunocoloração EdU. A linha branca tracejadaindica o limite entre o epitélio e o tecido conjuntivo. n=8. *P<0.05, **P<0.01, ***P<0.001 versus grupo veículo (CBD, 0mg/mL).#P<0.05, ##P<0.01, ###P<0.001 versus grupo de baixa dose (CBD, 1mg/mL).
Esta eficácia foi atribuída à capacidade do CBD de inibir a via do inflamassoma NLRP3 (família de receptores do tipo NOD, domínio de pirina contendo 3) e diminuir citocinas inflamatórias como IL-1β e IL-18. Análises histológicas evidenciaram inflamação reduzida e proliferação aumentada na camada subepitelial de úlceras tratadas com CBD, indicando cicatrização aprimorada. Adicionalmente, o CBD suprimiu a expressão da citidina monofosfato quinase 2 (CMPK2), reduzindo a síntese de DNA mitocondrial e a ativação adicional do inflamassoma.4
As propriedades antimicrobianas do CBD também podem contribuir para seu efeito benéfico no tratamento da mucosite oral. Estudos demonstraram que o CBD apresenta eficácia na redução de colônias de cepas bacterianas orais e biofilmes, suprimindo o crescimento de patógenos periodontais como Porphyromonas gingivalis. Considerando que infecções secundárias frequentemente complicam o quadro clínico da mucosite oral, esta ação antimicrobiana representa um benefício adicional.5
Em um contexto clínico, Umpreecha e colaboradores conduziram um ensaio clínico randomizado avaliando a eficácia da aplicação de pasta oral de CBD a 0,1% em úlceras aftosas recorrentes, que compartilham características com lesões de mucosite. O protocolo de aplicação três vezes ao dia por sete dias reduziu significativamente o tamanho das úlceras e as bordas eritematosas em comparação ao placebo, especialmente nos estágios iniciais do tratamento. O CBD também demonstrou efeitos analgésicos notáveis, reduzindo as pontuações de dor de forma mais eficaz, com maior satisfação do paciente e ausência de reações adversas.6
As evidências científicas disponíveis sugerem que os canabinoides, particularmente o CBD, representam uma abordagem terapêutica promissora para o tratamento da mucosite oral, atuando através de múltiplos mecanismos, incluindo modulação da inflamação, redução do estresse oxidativo, alívio da dor e potencial antimicrobiano. Embora o potencial terapêutico desses compostos seja inegável para melhorar a qualidade de vida dos pacientes, sua consolidação no uso clínico exige estudos adicionais em larga escala, a fim de fortalecer as evidências científicas sobre o tema.
Conclusão
Os canabinoides apresentam um potencial terapêutico significativo no manejo da mucosite oral, oferecendo propriedades anti-inflamatórias, analgésicas e cicatrizantes. Sua ação no sistema endocanabinoide pode não apenas reduzir a dor e a inflamação, mas também modular a resposta imunológica e promover a regeneração tecidual, destacando-se como uma alternativa promissora aos tratamentos convencionais.
Embora mais estudos clínicos sejam necessários para validar sua eficácia e segurança a longo prazo, as evidências atuais sugerem que os canabinoides podem representar um avanço importante na oncologia de suporte. Seu uso controlado e baseado em evidências pode melhorar significativamente a qualidade de vida dos pacientes, minimizando os impactos debilitantes da mucosite oral.
O aprofundamento do conhecimento sobre a interação entre os canabinoides e a boca abre novas perspectivas terapêuticas, com potencial significativo para beneficiar os pacientes. Nesse sentido, a WeCann Academy tem um papel fundamental, oferecendo suporte aos profissionais da saúde na compreensão do uso de canabinoides na prática clínica. A instituição disponibiliza recursos técnicos, como o Tratado de Medicina Endocanabinoide, capacitando profissionais de saúde com embasamento científico para integrar terapias à base de cannabis de forma segura e eficaz. Essa abordagem enriquece as opções terapêuticas disponíveis, promovendo um cuidado mais individualizado e fundamentado em evidências científicas.
Referências
- ALBUQUERQUE, Ana Carolina Lyra de; SOARES, Maria Sueli Marques; SILVA, Daniel Furtado. Mucosite oral: patobiologia, prevenção e tratamento. Comunicações em Ciências da Saúde, Brasília, v. 21, n. 2, p. 133-138, 25 nov. 2010. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/lil-619047.
- Bellocchio, L.; Patano, A.; Inchingolo, A.D.; Inchingolo, F.; Dipalma, G.; Isacco, C.G.; de Ruvo, E.; Rapone, B.; Mancini, A.; Lorusso, F.; et al. Cannabidiol for Oral Health: A New Promising Therapeutical Tool in Dentistry. Int. J. Mol. Sci. 2023, 24, 9693. https://doi.org/10.3390/ijms24119693
- Lowe H, Toyang N, Steele B, et al. The Current and Potential Application of Medicinal Cannabis Products in Dentistry. Dent J (Basel). 2021;9(9):106. doi:10.3390/dj9090106. PMID: 34562980; PMCID: PMC8466648.
- Qi X, Lin W, Wu Y, et al. CBD promotes oral ulcer healing via inhibiting CMPK2-mediated inflammasome. J Dent Res. 2022;101(2):206–215. doi:10.1177/00220345211024528
- Gu Z., Singh S., Niyogi R.G., Lamont G.J., Wang H., Lamont R.J., Scott D.A. Marijuana-derived cannabinoids trigger a CB2/PI3K axis of suppression of the innate response to oral pathogens. Front. Immunol. 2019;10:2288. doi: 10.3389/fimmu.2019.02288.
- Umpreecha C, Bhalang K, Charnvanich D, Luckanagul J. Efficacy and safety of topical 0.1% cannabidiol for managing recurrent aphthous ulcers: a randomized controlled trial. BMC Complement Med Ther. 2023;23(1):57. doi:10.1186/s12906-023-03886-0
- David, Carla et al. “Cannabidiol in Dentistry: A Scoping Review.” Dentistry journal vol. 10,10 193. 17 Oct. 2022, doi:10.3390/dj10100193
