O câncer de pele representa um dos tipos mais comuns de neoplasia maligna em todo o mundo, com incidência crescente nas últimas décadas. Apesar dos avanços significativos nas terapias convencionais, a busca por novas modalidades terapêuticas permanece constante. Neste contexto, os fitocanabinoides derivados da Cannabis sativa têm emergido como possíveis agentes antitumorais, suscitando interesse crescente na comunidade científica e médica.
No post de hoje, vamos abordar o estado atual da pesquisa sobre os canabinoides e seu potencial terapêutico no tratamento do câncer de pele, com ênfase nos mecanismos celulares e moleculares envolvidos e nas perspectivas de aplicação clínica.
Veja nessa postagem
Câncer de pele
O câncer de pele constitui a neoplasia maligna mais comum na população humana, apresentando uma incidência crescente em nível global nas últimas décadas. É classificado em dois grandes grupos: melanoma cutâneo e câncer de pele não melanoma (CPNM), sendo este último amplamente representado pelos carcinomas basocelular (CBC) e espinocelular (CEC).¹
No Brasil, dados do Instituto Nacional do Câncer (INCA) estimam cerca de 185 mil novos casos de CPNM por ano, representando aproximadamente 30% de todas as neoplasias malignas registradas no país. O melanoma, embora responsável por apenas 3% dos cânceres cutâneos, é notório por sua elevada morbimortalidade, com cerca de 8.450 novos diagnósticos anuais.²
Diversos fatores de risco contribuem para o desenvolvimento do câncer de pele. A exposição solar cumulativa ao longo da vida, especialmente à radiação ultravioleta B (UVB), está fortemente associada ao CPNM. Já os episódios de queimadura solar intensa, particularmente na infância e adolescência, estão mais ligados à gênese do melanoma. Indivíduos com fototipos I e II – pele clara, olhos claros, cabelos loiros ou ruivos – são especialmente suscetíveis.¹
Outros fatores relevantes incluem história familiar de melanoma (em até 10% dos casos), imunossupressão (particularmente em transplantados ou pacientes em uso crônico de imunossupressores), exposição ocupacional ou ambiental a carcinógenos como arsênico e hidrocarbonetos aromáticos, além da presença de lesões precursoras, como queratoses actínicas (CEC) e nevos melanocíticos atípicos (melanoma).¹
A apresentação clínica varia conforme o subtipo histológico. O CBC geralmente se manifesta como uma lesão papulosa ou nodular de crescimento lento, com superfície perolada e presença de telangiectasias, predominando em áreas fotoexpostas como a face – em especial o nariz e a região malar. Embora raramente cause metástase, pode gerar invasão local significativa quando não tratado.¹
O CEC, por sua vez, costuma se apresentar como lesão eritematosa, hiperqueratósica ou ulcerada, frequentemente originada a partir de queratoses actínicas. Tem crescimento mais rápido que o CBC e potencial metastático considerável, sobretudo para linfonodos regionais. Localiza-se com frequência no couro cabeludo, face, orelhas e dorso das mãos.¹
O melanoma cutâneo é caracterizado por lesão pigmentada com critérios clínicos clássicos do ABCDE (Assimetria, Bordas irregulares, Coloração heterogênea, Diâmetro maior que 6 mm e Evolução rápida). Pode surgir de novo ou a partir de nevos pré-existentes e apresenta subtipos histológicos distintos, como o extensivo superficial, nodular, lentigo maligno e o acral lentiginoso. Trata-se de uma neoplasia agressiva, com alto potencial de disseminação linfática e hematogênica, sendo o prognóstico fortemente influenciado pela espessura tumoral (índice de Breslow) e pelo estágio ao diagnóstico.¹

O diagnóstico inicial é predominantemente clínico, sendo a dermatoscopia uma ferramenta essencial na avaliação das lesões suspeitas, permitindo visualização de estruturas morfológicas não visíveis a olho nu. A confirmação se dá por exame histopatológico de material obtido por biópsia incisional ou excisional. Em casos selecionados, técnicas complementares como microscopia confocal in vivo, tomografia de coerência óptica e análises moleculares específicas podem ser empregadas. Exames de imagem, como ultrassonografia, tomografia computadorizada, ressonância magnética e PET-CT, são indicados para estadiamento em situações de doença avançada.¹
Além do risco oncológico, o câncer de pele pode comprometer profundamente a qualidade de vida do paciente. As manifestações físicas incluem dor, desconforto, limitação funcional – especialmente quando há acometimento de mãos, pés ou articulações – e desfiguração estética, particularmente relevante em lesões faciais. Os tratamentos, embora muitas vezes curativos, também podem provocar efeitos adversos importantes, como cicatrizes, dor neuropática e linfedema.
No âmbito psicossocial, pacientes frequentemente relatam ansiedade, depressão e comprometimento da autoimagem. O receio constante de recidiva ou desenvolvimento de novas lesões (fenômeno conhecido como “cancerfobia”) e as alterações no estilo de vida, como restrições à exposição solar, impactam negativamente o bem-estar.
O tratamento do câncer de pele é individualizado e depende do subtipo histológico, do estadiamento e das condições clínicas do paciente. Em casos de CBC e CEC, a excisão cirúrgica com margens de segurança adequadas é a principal forma de tratamento. Outras abordagens incluem crioterapia, curetagem e eletrodissecação, radioterapia, terapias tópicas, terapia fotodinâmica e, em casos avançados, uso de inibidores da via Hedgehog ou imunoterapia com anticorpos.
No manejo do melanoma, realiza-se excisão cirúrgica com margens proporcionais à espessura tumoral. A biópsia do linfonodo sentinela é indicada para melanomas ≥0,8 mm ou com características histológicas de alto risco. Nos casos com metástase linfonodal, pode-se realizar linfadenectomia terapêutica. Tratamentos adjuvantes incluem imunoterapia e terapia-alvo. Para doença avançada, além das opções mencionadas, considera-se quimioterapia, radioterapia paliativa e, em situações específicas, metastasectomia.
Apesar dos avanços nas terapias convencionais, o câncer de pele em estágio avançado ou refratário continua representando um importante desafio clínico. As limitações dos tratamentos disponíveis nesses casos, associadas ao impacto significativo na qualidade de vida dos pacientes, têm impulsionado a busca por abordagens terapêuticas inovadoras. Nesse contexto, cresce o interesse científico pelo uso de compostos derivados da Cannabis sativa como agentes terapêuticos adjuvantes ou alternativos no manejo do câncer de pele.
Sistema Endocanabinoide e Câncer de Pele
O sistema endocanabinoide (SEC) é uma rede de sinalização lipídica envolvida na regulação da homeostase fisiológica em múltiplos tecidos, incluindo o sistema nervoso, imunológico e tegumentar. Ele é constituído principalmente pelos receptores canabinoides CB1 e CB2, os ligantes endógenos como a anandamida (AEA) e o 2-araquidonoilglicerol (2-AG), além das enzimas de síntese e degradação desses ligantes, como a FAAH e a MAGL. Também fazem parte do SEC os receptores não canabinoides ativados por esses ligantes, como os canais TRPV (subtipos TRPV1-4) e os receptores nucleares PPARs, que participam de funções celulares complexas, incluindo proliferação, inflamação e diferenciação celular.³
A presença do SEC na pele foi confirmada a partir da década de 1990, quando se detectou AEA em tecido cutâneo de ratos, em concentrações comparáveis às observadas no cérebro. Desde então, diversos estudos têm mostrado que os componentes do SEC estão amplamente distribuídos na pele humana, incluindo nos queratinócitos, melanócitos, mastócitos, macrófagos, nervos sensoriais peptidérgicos, além das glândulas sudoríparas écrinas, folículos pilosos e sebócitos. A ativação tônica dos receptores canabinoides nesses tecidos regula funções essenciais como a melanogênese, regeneração tecidual, resposta imune cutânea e barreira epidérmica, sendo reconhecida como um importante eixo neuroendócrino na manutenção da homeostase da pele.4
No contexto do câncer de pele, há crescente interesse em compreender o papel do SEC na tumorigênese e progressão de neoplasias cutâneas, como o melanoma e o carcinoma espinocelular. Estudos recentes demonstraram uma regulação positiva do receptor CB2 em tecidos de melanoma, o que sugere uma possível participação desse receptor na biologia tumoral.5
Além disso, a expressão de CB1 e CB2 em tecidos tumorais tem sido associada a desfechos clínicos variáveis. Em alguns subtipos de carcinoma espinocelular, por exemplo, a presença de CB1 foi correlacionada com pior prognóstico e menor sobrevida, enquanto em outros, como no carcinoma espinocelular de língua, a maior expressão de CB2 esteve associada a maior sobrevida global e livre de doença.6,7
Paralelamente, elementos enzimáticos do SEC também parecem desempenhar papel relevante na agressividade tumoral. A expressão aumentada da MAGL (monoacilglicerol lipase), por exemplo, foi observada em tecidos de melanoma, sendo associada a maior potencial metastático e progressão tumoral. Esses achados apontam para uma complexa e ainda não totalmente compreendida interação entre o SEC e a oncogênese cutânea, com efeitos que podem variar conforme o tipo celular, subtipo tumoral, sexo e idade do paciente.8
Embora mais estudos clínicos sejam necessários para elucidar completamente o papel funcional dos canabinoides e de seus receptores no câncer de pele, as evidências atuais indicam que o SEC pode representar uma via terapêutica promissora. A modulação farmacológica do SEC, por meio de fitocanabinoides ou canabinoides sintéticos, possuem um potencial terapêutico de atuarem como estratégia adjuvante ou alternativa no tratamento de neoplasias cutâneas, especialmente em casos avançados ou refratários às terapias convencionais.
Evidências Científicas
Evidências pré-clínicas em neoplasias cutâneas
Efeitos antiproliferativos e pró-apoptóticos
No contexto do melanoma, uma das mais agressivas formas de câncer de pele, as pesquisas indicam um potencial promissor dos canabinoides. Em 2006, Blázquez et al. demonstraram que a ativação dos receptores canabinoides CB1 e CB2 em linhagens celulares de melanoma humano resultou em uma significativa redução do crescimento, proliferação e metástase, além de atenuar a neovascularização tumoral. Essa atividade antiproliferativa foi associada à modulação dos checkpoints do ciclo celular e à inibição da proteína quinase B (Akt), uma via crucial para a sobrevivência celular.9
Adicionalmente, estudos avaliaram o CBD em modelos de melanoma em camundongos, evidenciando uma diminuição substancial do tamanho do tumor e um aumento na sobrevida dos animais tratados, os quais também apresentaram melhor qualidade de vida e desempenho físico.10 Outras investigações corroboram a capacidade do óleo de CBD em inibir o crescimento de células de melanoma in vitro, embora o mecanismo pró-apoptótico específico do CBD ainda esteja sendo elucidado.11
A exploração dos endocanabinoides, como a anandamida (AEA), e de inibidores de suas enzimas degradadoras, também revelou citotoxicidade dependente da concentração em células de melanoma, induzindo a apoptose. A inibição da enzima FAAH, responsável pela degradação da AEA, potencializou seus efeitos antitumorais, e metabólitos da AEA, como a PGD2 etanolamida, igualmente induziram apoptose.12
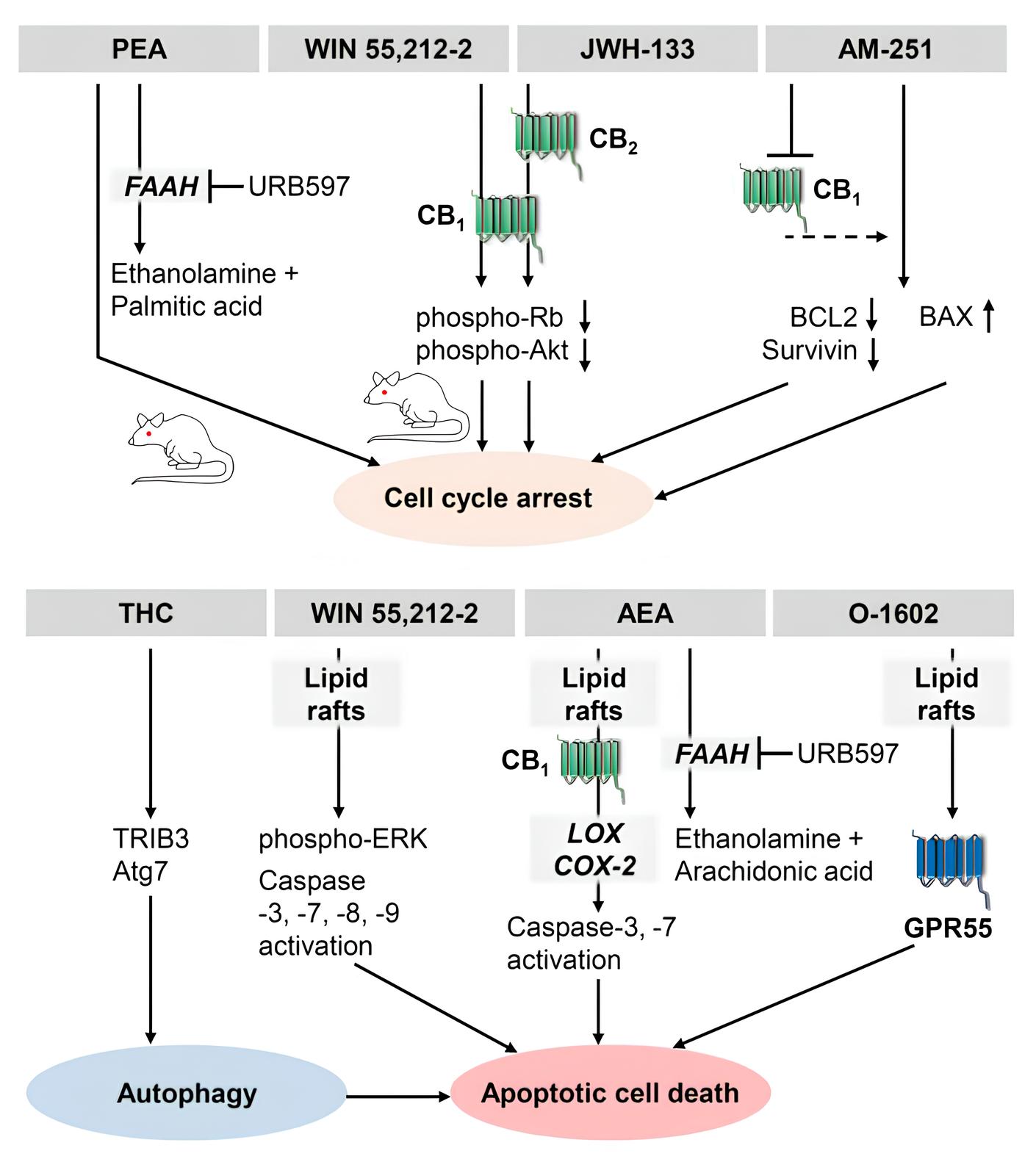
De modo análogo, nos carcinomas de células escamosas (CCE), o canabinoide sintético WIN 55,212-2 e o agonista seletivo de CB2, JWH-133, induziram apoptose em células de CCE murino in vitro e reduziram o crescimento tumoral em modelos de xenoenxerto. Nesses carcinomas, os canabinoides podem induzir a morte celular por mecanismos independentes da ativação direta de receptores canabinoides.13
Considerando que muitos cânceres de pele não melanoma superexpressam a enzima COX-2, estudos demonstraram que a AEA, quando metabolizada pela COX-2, pode gerar metabólitos citotóxicos que induzem morte celular em queratinócitos tumorais, um processo que pode envolver o estresse do retículo endoplasmático e a geração de espécies reativas de oxigênio (ROS). O CBD também demonstrou reduzir significativamente a viabilidade de linhagens celulares de carcinoma de língua humana e induzir apoptose, particularmente em concentrações mais elevadas.14,15
Inibição da Motilidade, Invasão e Metástase
A capacidade de células neoplásicas migrarem, invadirem tecidos adjacentes e estabelecerem metástases à distância é fundamental para a progressão da doença. Diversas publicações indicam que os canabinoides podem inibir esses processos tanto no melanoma quanto, em menor grau, no carcinoma de células escamosas.
No melanoma, a ativação do receptor CB2 com JWH-133 demonstrou reduzir a adesão e a migração transendotelial de células, sugerindo um papel na prevenção de metástases cerebrais. Estudos in vitro também revelaram que extratos padronizados de cannabis diminuíram a migração de células de melanoma. Já em modelos in vivo, o tratamento com WIN 55,212-2 reduziu o número de nódulos metastáticos em pulmões e fígados de camundongos. 16,17
No que tange aos carcinomas de células escamosas, os dados são mais limitados, porém indicam que o CBD pode reduzir a invasão de células de carcinoma de língua oral em baixas concentrações micromolares. Notavelmente, este estudo mostrou que 5 mg/kg de CBD, administrado via intraperitoneal, 3 vezes por semana reduziu a área tumoral que se desenvolveu após a injeção da linha celular de carcinoma de células hipofaríngeas.18
Potencial quimiopreventivo dos canabinoides no Câncer de Pele
Há indícios de que os canabinoides possam exercer um efeito quimiopreventivo no câncer de pele, em parte devido às suas propriedades anti-inflamatórias. Compostos não psicotrópicos como o canabicromeno (CBC), canabidivarina (CBDV), canabigerol (CBG), canabigerol (CBGV) e Δ9-tetrahidrocanabivarina (THCV) demonstraram regular negativamente a liberação de citocinas pró-inflamatórias, IL-1α, IL-1β, IL-6, IL-8 e fator de necrose tumoral (TNF)-α em sebócitos.19
Esses achados na prevenção do câncer de pele são logicamente fundamentados na compreensão atual da carcinogênese, que reconhece a inflamação crônica como um fator crucial na iniciação e progressão tumoral. Ao suprimir a liberação de citocinas pró-inflamatórias em sebócitos, esses compostos atuam diretamente no microambiente cutâneo, neutralizando um dos principais impulsionadores do dano celular e da proliferação descontrolada. Este mecanismo anti-inflamatório evita que o ambiente tecidual se torne permissivo ao desenvolvimento neoplásico, protegendo as células da pele contra os efeitos deletérios da inflamação persistente.
O CBD, em particular, tem sido associado à prevenção do câncer de pele. Estudos demonstram que o CBD aumenta a atividade de enzimas antioxidantes em queratinócitos expostos à radiação UV, sugerindo um papel protetor. Além disso, a aplicação tópica de CBD em ratos irradiados com luz UVA e UVB resultou em um aumento de compostos anti-inflamatórios e na redução de mediadores pró-inflamatórios e pró-tumorais, reforçando seu potencial preventivo.20,21
Desafios e Perspectivas Futuras
Apesar dos promissores resultados pré-clínicos, os dados relativos aos efeitos sistêmicos dos canabinoides na carcinogênese em pacientes com câncer permanecem muito limitados.
Os estudos até o momento não focam especificamente nos canabinoides como uma opção terapêutica primária para o câncer de pele. A maioria dos estudos clínicos em oncologia tem priorizado o manejo de sintomas relacionados ao câncer e seus tratamentos, como dor crônica e náuseas/vômitos induzidos pela quimioterapia.
Em suma, as evidências pré-clínicas consistentemente indicam que os canabinoides, tanto fitocanabinoides quanto endocanabinoides, possuem um promissor potencial antitumoral no melanoma e nos carcinomas de células escamosas. Seus mecanismos de ação abrangem a inibição da proliferação celular, indução da apoptose, redução da angiogênese, inibição da motilidade, invasão e metástase, além de potenciais efeitos preventivos.
No entanto, a translação desses achados para a prática clínica no tratamento do câncer de pele impõe a necessidade de ensaios clínicos robustos em humanos. Tais estudos são indispensáveis para determinar a segurança, eficácia, posologia ideal, formulação adequada e as potenciais interações com terapias convencionais. A complexidade dos mecanismos de ação dos canabinoides e as observações de efeitos opostos em diferentes contextos celulares e concentrações sublinham a necessidade de uma pesquisa rigorosa e uma abordagem cautelosa e personalizada para o uso da cannabis medicinal em oncologia.
Conclusão
Os dados emergentes da pesquisa pré-clínica sobre o uso de canabinoides no tratamento e prevenção do câncer de pele são inegavelmente promissores, delineando um cenário de múltiplos mecanismos de ação que abrangem a inibição da proliferação, indução de apoptose, e a capacidade de mitigar a inflamação crônica. No entanto, a translação dessas descobertas para a prática clínica exige cautela e rigor científico, dada a ainda limitada quantidade de ensaios clínicos em humanos focados especificamente no câncer de pele.
Diante desse panorama em constante evolução, é essencial que os médicos se mantenham atualizados e busquem aprofundamento nesse campo. A cannabis medicinal, com sua complexidade de componentes e interações, representa uma área de conhecimento que transcende a formação médica tradicional. A compreensão dos mecanismos de ação dos canabinoides, dos perfis de segurança, das potenciais interações medicamentosas e das melhores práticas de prescrição é fundamental.
Integrar o conhecimento sobre canabinoides ao arsenal terapêutico habitual, com respaldo científico, pode abrir novos caminhos para o manejo do câncer de pele, seja no controle sintomático, na terapia adjuvante ou, futuramente, em estratégias de quimioprevenção. É, portanto, uma responsabilidade profissional e um compromisso com o cuidado de excelência que os médicos se preparem para discutir e, quando apropriado, incorporar esta modalidade terapêutica promissora, garantindo assim, um melhor e mais completo cuidado aos seus pacientes.
ELEVE SUA PRÁTICA CLÍNICA A UM NOVO PATAMAR

Após aprender sobre o potencial terapêutico da cannabis medicinal no contexto oncológico, mais especificamente no câncer de pele, convidamos você para dar o próximo passo em sua jornada profissional com o WeCann Summit 2025 – o mais importante evento internacional dedicado à medicina endocanabinoide e inovações terapêuticas na saúde.
O WeCann Summit 2025, que acontecerá nos dias 23, 24 e 25 de outubro no Royal Palm Hall, em Campinas, representa uma oportunidade única para aprofundar seu conhecimento sobre o sistema endocanabinoide, suas aplicações clínicas em diversas condições, e novas e promissoras fronteiras da Medicina, como sistemas de suporte à decisão clínica baseados em Inteligência Artificial.
Este evento reúne experts de quatro continentes, oferecendo:
- Conteúdo técnico altamente qualificado;
- Protocolos práticos para implementação imediata em seu consultório;
- Rede de contatos com especialistas e colegas de +50 especialidades e áreas de atuação.
O WeCann Summit 2025 é mais do que um congresso médico: é o ponto de encontro entre ciência, inovação e prática médica de excelência.
Seu passaporte para novas fronteiras da Medicina está disponível apertando no botão abaixo:
Referências
- Araújo Lima Júnior, I., das Virgens Lisboa, A., Gabriel Gonçalves Ferreira, M., Maximiano de Paula Júnior , A., Jardim Gomes , C., Aparecida de Souza, J., Michel Pereira de Oliveira, O., Ramos Vaz , G., da Silva Santos , S., Matos Bezerra, V., Elvira Calmon de Araújo Mascarenhas, M., & Victor Paranaguá Caram Salvadego, J. (2024). Câncer de pele: uma revisão de literatura. Brazilian Journal of Implantology and Health Sciences, 6(4), 2493–2501.
- INSTITUTO NACIONAL DE CÂNCER JOSÉ ALENCAR GOMES DA SILVA. Estimativa 2023: incidência de câncer no Brasil. Rio de Janeiro: INCA, 2022. Disponível em: https://www.inca.gov.br/publicacoes/livros/estimativa-2023-incidencia-de-cancer-no-brasil.
- MONTAGNER, Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Ramer, Robert et al. “Impact of Cannabinoid Compounds on Skin Cancer.” Cancers vol. 14,7 1769. 31 Mar. 2022, doi:10.3390/cancers14071769
- Zhao Z., Yang J., Zhao H., Fang X., Li H. Cannabinoid receptor 2 is upregulated in melanoma. J. Cancer Res. Ther. 2012;8:549–554. doi: 10.4103/0973-1482.106534.
- Klein Nulent T.J.W., van Diest P.J., van der Groep P., Leusink F.K.J., Kruitwagen C.L.J.J., Koole R., van Cann E.M. Cannabinoid receptor-2 immunoreactivity is associated with survival in squamous cell carcinoma of the head and neck. Br. J. Oral Maxillofac. Surg. 2013;51:604–609. doi: 10.1016/j.bjoms.2013.03.015.
- Theocharis S., Giaginis C., Alexandrou P., Rodriguez J., Tasoulas J., Danas E., Patsouris E., Klijanienko J. Evaluation of cannabinoid CB1 and CB2 receptors expression in mobile tongue squamous cell carcinoma: Associations with clinicopathological parameters and patients’ survival. Tumour Biol. 2016;37:3647–3656. doi: 10.1007/s13277-015-4182-8.
- Baba Y., Funakoshi T., Mori M., Emoto K., Masugi Y., Ekmekcioglu S., Amagai M., Tanese K. Expression of monoacylglycerol lipase as a marker of tumour invasion and progression in malignant melanoma. J. Eur. Acad. Dermatol. Venereol. 2017;31:2038–2045. doi: 10.1111/jdv.14455.
- Blázquez C., Carracedo A., Barrado L., Real P.J., Fernández-Luna J.L., Velasco G., Malumbres M., Guzmán M. Cannabinoid receptors as novel targets for the treatment of melanoma. FASEB J. 2006;20:2633–2635. doi: 10.1096/fj.06-6638fje.
- Simmerman E., Qin X., Yu J.C., Baban B. Cannabinoids as a Potential New and Novel Treatment for Melanoma: A Pilot Study in a Murine Model. J. Surg. Res. 2019;235:210–215. doi: 10.1016/j.jss.2018.08.055.
- Burch R., Mortuza A., Blumenthal E., Mustafa A. Effects of cannabidiol (CBD) on the inhibition of melanoma cells in vitro. J. Immunoass. Immunochem. 2021;42:285–291. doi: 10.1080/15321819.2020.1862863.
- Adinolfi B., Romanini A., Vanni A., Martinotti E., Chicca A., Fogli S., Nieri P. Anticancer activity of anandamide in human cutaneous melanoma cells. Eur. J. Pharmacol. 2013;718:154–159. doi: 10.1016/j.ejphar.2013.08.039.
- Casanova M.L., Blázquez C., Martínez-Palacio J., Villanueva C., Fernández-Aceñero M.J., Huffman J.W., Jorcano J.L., Guzmán M. Inhibition of skin tumor growth and angiogenesis in vivo by activation of cannabinoid receptors. J. Clin. Investig. 2003;111:43–50. doi: 10.1172/JCI200316116.
- van Dross R.T. Metabolism of anandamide by COX-2 is necessary for endocannabinoid-induced cell death in tumorigenic keratinocytes. Mol. Carcinog. 2009;48:724–732. doi: 10.1002/mc.20515.
- Huang C.-C., Tung T.-H., Huang C.-C., Lin S.-Y., Chao S.-C., Chiu S.-P., Lee S.-P., Lo C.-M. Electrochemical Assessment of Anticancer Compounds on the Human Tongue Squamous Carcinoma Cells. Sensors. 2020;20:2632. doi: 10.3390/s20092632.
- Haskó J., Fazakas C., Molnár J., Nyúl-Tóth Á., Herman H., Hermenean A., Wilhelm I., Persidsky Y., Krizbai I.A. CB2 receptor activation inhibits melanoma cell transmigration through the blood-brain barrier. Int. J. Mol. Sci. 2014;15:8063–8074. doi: 10.3390/ijms15058063.
- Blázquez C., Carracedo A., Barrado L., Real P.J., Fernández-Luna J.L., Velasco G., Malumbres M., Guzmán M. Cannabinoid receptors as novel targets for the treatment of melanoma. FASEB J. 2006;20:2633–2635. doi: 10.1096/fj.06-6638fje.
- Go Y.Y., Kim S.R., Kim D.Y., Chae S.-W., Song J.-J. Cannabidiol enhances cytotoxicity of anti-cancer drugs in human head and neck squamous cell carcinoma. Sci. Rep. 2020;10:20622. doi: 10.1038/s41598-020-77674-y.
- Oláh A., Markovics A., Szabó-Papp J., Szabó P.T., Stott C., Zouboulis C.C., Bíró T. Differential effectiveness of selected non-psychotropic phytocannabinoids on human sebocyte functions implicates their introduction in dry/seborrhoeic skin and acne treatment. Exp. Dermatol. 2016;25:701–707. doi: 10.1111/exd.13042.
- Jastrząb A., Gęgotek A., Skrzydlewska E. Cannabidiol Regulates the Expression of Keratinocyte Proteins Involved in the Inflammation Process through Transcriptional Regulation. Cells. 2019;8:827. doi: 10.3390/cells8080827.
- Łuczaj W., Jastrząb A., do Rosário Domingues M., Domingues P., Skrzydlewska E. Changes in Phospholipid/Ceramide Profiles and Eicosanoid Levels in the Plasma of Rats Irradiated with UV Rays and Treated Topically with Cannabidiol. Int. J. Mol. Sci. 2021;22:8700. doi: 10.3390/ijms22168700.
