A Síndrome dos Ovários Policísticos (SOP) é um distúrbio endócrino complexo que afeta milhões de mulheres em idade reprodutiva em todo o mundo. Caracterizada por uma combinação de sintomas como irregularidade menstrual, hiperandrogenismo (níveis elevados de hormônios masculinos) e presença de múltiplos pequenos cistos nos ovários, a SOP representa um desafio significativo tanto para as pacientes quanto para os profissionais de saúde.
Seus efeitos vão além dos aspectos reprodutivos, podendo incluir complicações metabólicas como resistência à insulina, diabetes tipo 2, dislipidemia e risco cardiovascular aumentado. Diante das limitações das terapias convencionais e dos efeitos colaterais associados aos medicamentos tradicionais, tem crescido o interesse por abordagens alternativas e complementares para o manejo da SOP.
Neste contexto, a terapia com cannabis medicinal emergiu como uma potencial aliada terapêutica, especialmente devido às propriedades anti-inflamatórias, metabólicas e neuroendócrinas dos canabinoides. No post de hoje vamos explorar o estado atual das evidências científicas sobre o potencial uso da cannabis e seus derivados no tratamento dos diversos aspectos da SOP, analisando os mecanismos de ação e benefícios potenciais.
Veja nessa postagem
Entendendo a Síndrome dos Ovários Policísticos
A Síndrome dos Ovários Policísticos (SOP) representa uma das condições endócrinas mais prevalentes em mulheres em idade reprodutiva, afetando entre 6 a 20% desta população, dependendo dos critérios diagnósticos utilizados. Inicialmente descrita por Stein-Leventhal em 1935, a SOP é caracterizada fundamentalmente pela presença de hiperandrogenismo e anovulação crônica, na ausência de outros diagnósticos específicos.¹
A etiopatogenia da SOP é complexa e multifatorial, envolvendo componentes genéticos, metabólicos e ambientais. Um dos mecanismos endócrinos centrais da síndrome é a hipersecreção característica do Hormônio Luteinizante (LH), considerada patognomônica, com aumento na amplitude dos pulsos secretórios, enquanto os níveis de Hormônio Folículo Estimulante (FSH) permanecem baixos ou no limite inferior da normalidade. Este desbalanço hormonal resulta na hiperatividade das células da teca ovariana, que passam a produzir quantidades elevadas de androgênios, principalmente testosterona, sem a conversão proporcional em estradiol, explicando o hiperandrogenismo clássico da doença.¹
Estudos demonstram que mulheres com SOP apresentam menor sensibilidade hipotalâmica ao retrocontrole exercido pelos estrogênios e progesterona de origem ovariana, com marcada resistência dos neurônios secretores de GnRH à regulação inibitória da progesterona. Esta resistência parece estar relacionada à redução da expressão dos receptores de progesterona nos neurônios hipotalâmicos, consequência dos níveis elevados de testosterona.¹
No aspecto metabólico, a resistência à insulina e a hiperinsulinemia compensatória são frequentes em portadoras de SOP, independentemente da presença de obesidade. A insulina exerce efeito sinérgico com o LH nas células da teca, estimulando a produção androgênica ovariana. Adicionalmente, a insulina reduz a produção hepática da proteína carreadora de androgênios (SHBG), resultando em maior concentração de testosterona livre circulante. O fator de crescimento insulina-símile 1 (IGF-1) também contribui para a produção aumentada de androgênios, estimulando a proliferação das células da teca.¹
A foliculogênese na SOP apresenta características distintas: o recrutamento e ativação folicular ocorrem intensamente, porém com menor atresia dos folículos em estágios iniciais. Os níveis reduzidos de FSH dificultam o desenvolvimento completo dos folículos até estágios maduros, fazendo com que permaneçam estacionados em fases intermediárias, conferindo aos ovários a morfologia policística característica.¹
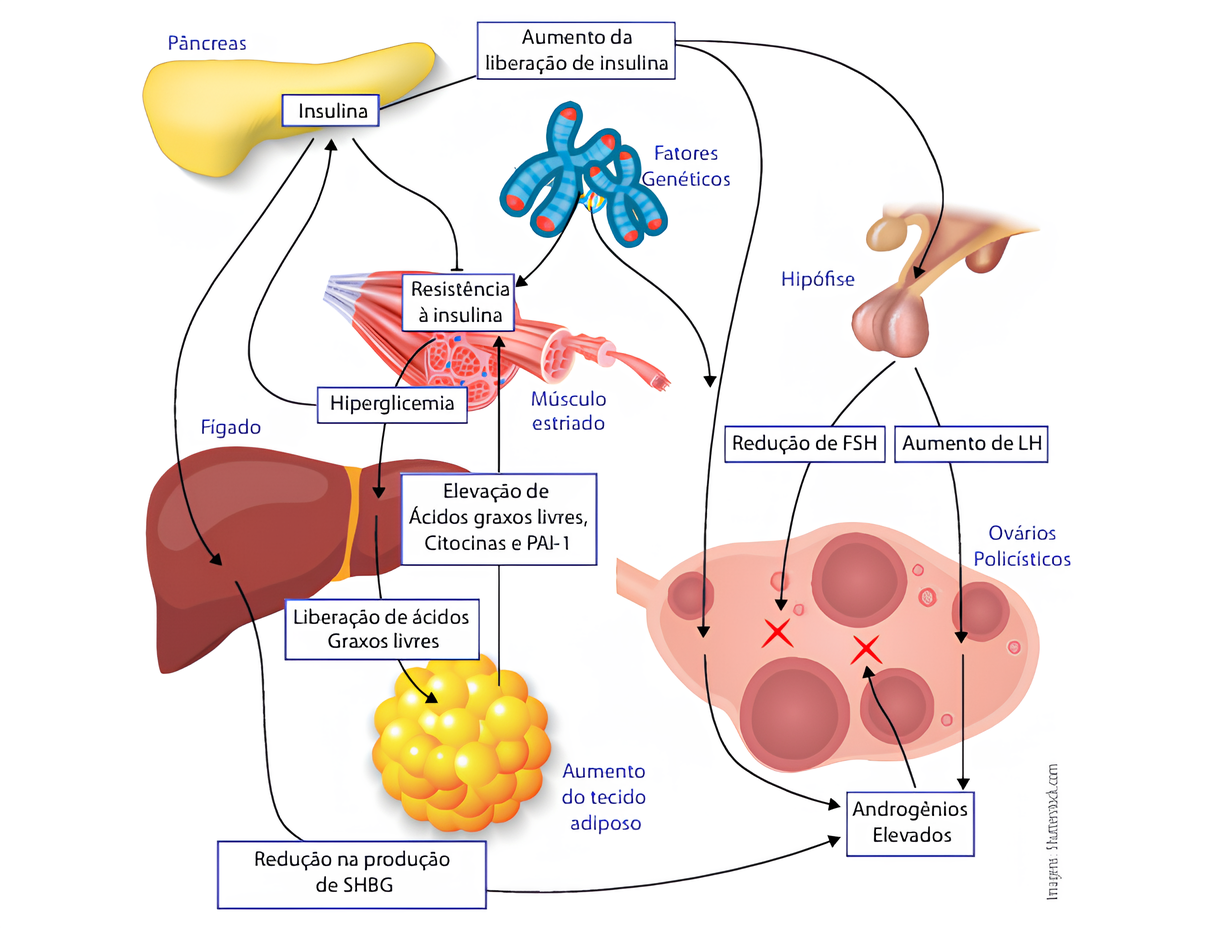
As manifestações clínicas da SOP são heterogêneas e variam consideravelmente entre as pacientes. O hiperandrogenismo pode se manifestar através de hirsutismo, acne, alopecia androgenética e irregularidades menstruais (oligomenorreia ou amenorreia). A infertilidade ou subfertilidade é frequente, resultante da disfunção ovulatória crônica. As complicações metabólicas incluem obesidade, resistência insulínica, diabetes tipo 2, dislipidemia, esteatose hepática não alcoólica e risco cardiovascular aumentado.¹
Além das manifestações físicas, a SOP está frequentemente associada a impactos psicológicos significativos. A alteração da imagem corporal decorrente do hirsutismo, acne e ganho de peso contribui para redução da autoestima e maior prevalência de ansiedade e depressão. Estudos demonstram que mulheres com SOP apresentam pior qualidade de vida relacionada à saúde quando comparadas à população feminina geral da mesma faixa etária.¹
O tratamento convencional da SOP é multidisciplinar e geralmente inclui modificações no estilo de vida (dieta e exercícios físicos), contraceptivos hormonais combinados para regularização menstrual e controle do hiperandrogenismo, antiandrógenos como espironolactona e finasterida, sensibilizadores de insulina (principalmente metformina) e, em casos de desejo reprodutivo, indutores de ovulação.
Apesar da eficácia comprovada em vários aspectos da síndrome, as terapias convencionais apresentam limitações significativas. Os contraceptivos hormonais, embora eficazes no controle dos sintomas androgênicos e na regularização menstrual, podem agravar a resistência insulínica e aumentar o risco cardiovascular em algumas pacientes. A metformina, frequentemente utilizada para melhorar a sensibilidade à insulina, está associada a efeitos gastrointestinais adversos que comprometem a adesão ao tratamento. Antiandrógenos como a espironolactona exigem uso prolongado para resultados satisfatórios e apresentam potencial teratogênico, exigindo contracepção eficaz concomitante.
Neste contexto de limitações terapêuticas, a cannabis medicinal tem emergido como potencial alternativa complementar no manejo da SOP. O sistema endocanabinoide está envolvido na regulação do eixo hipotálamo-hipófise-ovariano, metabolismo energético e processos inflamatórios. Estudos preliminares sugerem que canabinoides, como o canabidiol (CBD) podem atuar na melhoria da sensibilidade à insulina, redução da inflamação crônica de baixo grau e modulação da produção androgênica. Além disso, as propriedades ansiolíticas e antidepressivas dos fitocanabinoides podem beneficiar os aspectos psicológicos associados à síndrome.
Sistema Endocanabinoide e SOP
O sistema endocanabinoide (SEC) constitui uma complexa rede de sinalização celular que desempenha papel crucial na regulação de diversos processos fisiológicos, incluindo eventos reprodutivos femininos. Este sistema está presente em múltiplas estruturas do eixo hipotálamo-hipófise-ovário (HPO), com expressão de receptores canabinoides (CB1 e CB2), endocanabinoides como a anandamida (AEA), e enzimas responsáveis pela síntese e degradação destes compostos, como a NAPE-PLD (N-acil-fosfatidiletanolamina fosfolipase D) e a FAAH (amida hidrolase de ácidos graxos).²
No hipotálamo, os receptores CB1 estão localizados em áreas responsáveis pela produção do hormônio liberador de gonadotrofinas (GnRH), que atua como maestro na orquestra hormonal do ciclo menstrual. A principal função destes receptores CB1 no sistema nervoso central é regular a liberação de importantes neurotransmissores como o glutamato e o ácido gama-aminobutírico (GABA), que exercem efeitos modulatórios sobre a secreção de GnRH.³
Na hipófise anterior, os receptores CB1 também estão presentes, enquanto nos ovários encontram-se tanto receptores CB1 quanto CB2, sendo estes últimos expressos em níveis mais elevados, sugerindo possível papel imunológico do SEC na função ovariana. Outros componentes do sistema endocanabinoide, como AEA, FAAH e NAPE-PLD, foram identificados em diferentes estruturas do sistema reprodutivo feminino, incluindo folículos ovarianos (especialmente nos folículos secundários e terciários), corpo lúteo, corpo albicans, ovidutos, endométrio e miométrio.³
Interações entre o Sistema Endocanabinoide e o Eixo Hipotálamo-Hipófise-Ovário
O eixo HPO controla a série de eventos hormonais que regulam o ciclo menstrual e a ovulação. A sequência hormonal segue um padrão hierárquico: o hipotálamo libera GnRH de maneira pulsátil, que estimula a hipófise anterior a produzir e secretar as gonadotrofinas FSH (hormônio folículo-estimulante) e LH (hormônio luteinizante). Estas gonadotrofinas, por sua vez, regulam o desenvolvimento folicular e a produção ovariana de estrogênio e progesterona.
O sistema endocanabinoide interage com este eixo em vários níveis:
- Nível hipotalâmico: Os canabinoides, endógenos ou exógenos, modificam a secreção de GnRH por mecanismos indiretos, reduzindo a atividade do glutamato (que estimula a secreção de GnRH) e aumentando a atividade do GABA (que inibe a secreção de GnRH). Estudos utilizando células hipotalâmicas imortalizadas demonstraram que a estimulação do receptor CB1 resulta na inibição da secreção pulsátil de GnRH. Tanto a administração de AEA quanto o uso de agonistas de CB1 demonstraram suprimir a atividade elétrica dos neurônios GnRH.4,5
- Nível hipofisário: A redução da liberação de GnRH pelo hipotálamo leva à diminuição da produção e secreção de FSH e LH pela hipófise anterior.³
- Nível ovariano: O SEC influencia diretamente a função ovariana, com os receptores CB1 e CB2 presentes nos folículos ovarianos. Estudos revelaram que a AEA atua por mecanismos autócrinos nas células foliculares ovarianas, e que suas concentrações flutuam durante o ciclo ovariano, aumentando antes da ovulação. Demonstrou-se que a concentração de AEA no fluido folicular correlaciona-se positivamente com o tamanho folicular e a presença de oócitos maduros, sugerindo seu papel na foliculogênese e maturação oocitária.6,7
O estrogênio produzido pelos folículos em desenvolvimento inibe a FAAH, resultando em aumento da sinalização de AEA, o que contribui para a foliculogênese e ovulação. Após a ovulação, os níveis de estrogênio diminuem, liberando a inibição da FAAH, o que permite a degradação enzimática da AEA.³
Desregulação do Sistema Endocanabinoide na SOP
A Síndrome dos Ovários Policísticos é uma condição endócrina caracterizada por hiperandrogenismo, oligoanovulação e morfologia ovariana policística. Evidências crescentes sugerem que alterações no sistema endocanabinoide podem estar envolvidas na patogênese da SOP.
Perturbações na biossíntese e/ou degradação da AEA, que levam a um aumento na sua concentração, têm sido associadas a várias patologias, incluindo a SOP. Estudos identificaram níveis elevados de AEA sérica em mulheres com SOP, sugerindo uma desregulação do sistema endocanabinoide nesta condição.
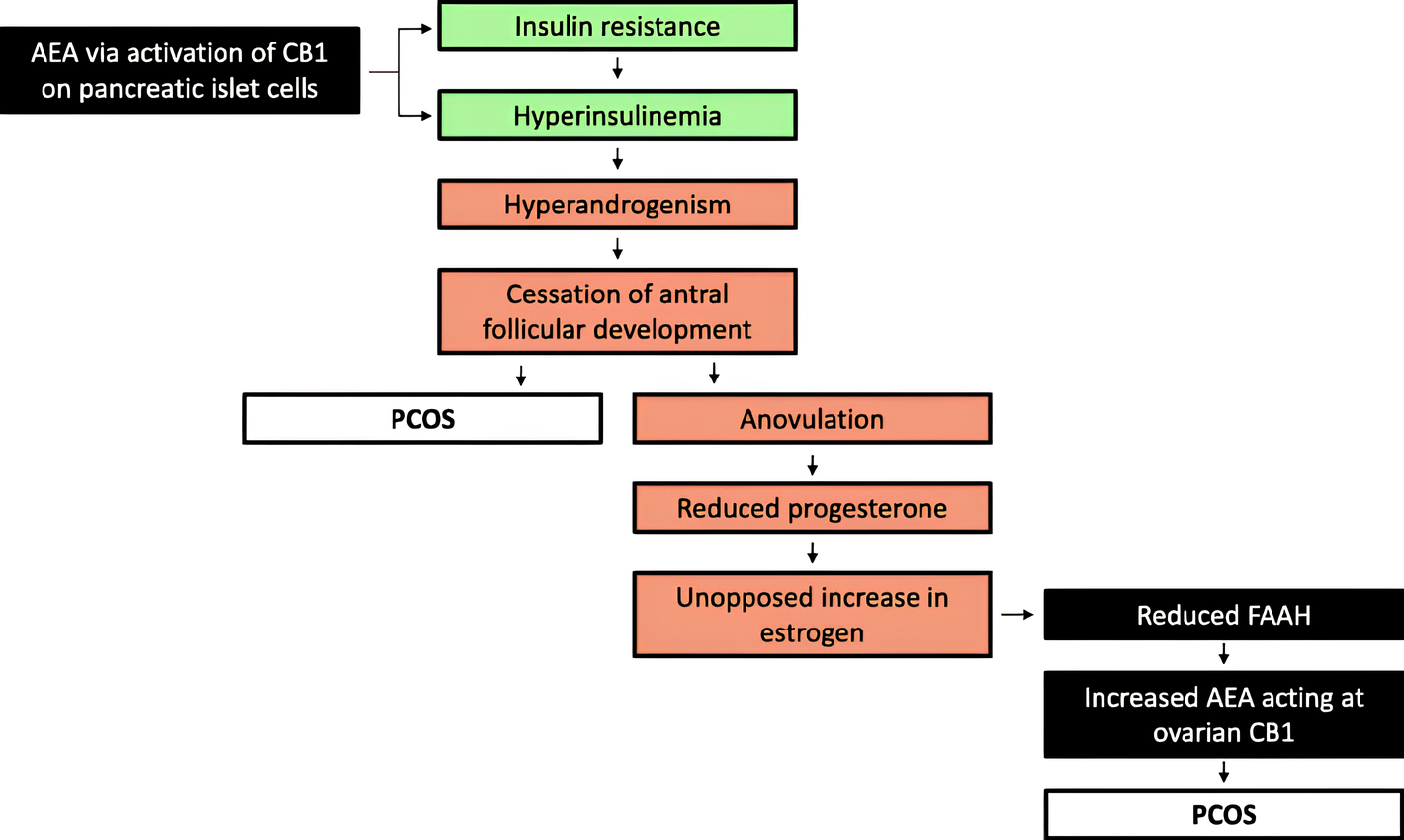
Os estudos conduzidos por Cui et al. investigaram a relação entre o SEC e a s-SOP, com foco na expressão da enzima amida hidrolase de ácidos graxos (FAAH), responsável pela degradação da anandamida, um dos principais endocanabinoides. Em sua análise, os pesquisadores compararam amostras endometriais de mulheres com e sem SOP e observaram que aquelas com SOP apresentavam níveis significativamente reduzidos de FAAH no endométrio.
Esse achado sugere que, nesses pacientes, há uma menor degradação da AEA, resultando em acúmulo do endocanabinoide e aumento da sinalização via receptores CB1 e CB2. Como a ativação de CB1 tem sido associada à resistência insulínica e a distúrbios metabólicos, esse desequilíbrio pode estar diretamente envolvido na patogênese da SOP, contribuindo para a disfunção ovariana, a anovulação e as irregularidades menstruais.8
Para testar essa hipótese, Cui et al. realizaram um estudo subsequente no qual mulheres não obesas com SOP foram tratadas com Diane-35, uma formulação combinada de etinilestradiol e acetato de ciproterona (um esteroide antiandrogênico), e metformina, um sensibilizador da insulina amplamente utilizado no manejo da SOP. Após o período de tratamento, os pesquisadores observaram uma normalização dos níveis de FAAH no endométrio e uma redução nos níveis circulantes de AEA, o que sugere que o SEC pode estar diretamente envolvido na fisiopatologia da SOP. O fato de que a intervenção hormonal e metabólica conseguiu reverter esse desbalanço reforça a ideia de que a regulação da sinalização endocanabinoide pode representar um potencial alvo terapêutico para essa síndrome.9
O sistema endocanabinoide representa um importante sistema regulador da função reprodutiva feminina, com impacto em múltiplos níveis do eixo HPO. Sua desregulação parece estar envolvida na patogênese da SOP, afetando processos críticos como a secreção de gonadotrofinas, esteroidogênese ovariana, foliculogênese e ovulação. Esta inter-relação entre SEC e SOP abre novas perspectivas para a compreensão da fisiopatologia da síndrome e pode representar potencial alvo terapêutico para o desenvolvimento de novas abordagens no manejo desta condição.
Evidências científicas
A relação entre o sistema endocanabinoide e a síndrome do ovário policístico tem sido alvo de investigações recentes, especialmente no que diz respeito à influência dos endocanabinoides sobre a resistência à insulina, obesidade e função ovariana. Dado que a SOP é frequentemente associada a distúrbios metabólicos, incluindo hiperinsulinemia e obesidade, o papel do SEC na homeostase energética sugere uma possível aplicação terapêutica dos canabinoides no manejo dessa condição.
No contexto do uso de canabinoides, o canabidiol (CBD) tem sido estudado por suas propriedades moduladoras do SEC. O CBD tem sido proposto como um antagonista funcional de CB1 e pode reduzir a ativação exacerbada desse receptor, potencialmente mitigando a resistência à insulina e melhorando a homeostase metabólica em mulheres com SOP. Além disso, suas propriedades anti-inflamatórias e ansiolíticas podem ser benéficas no manejo dos sintomas associados, como inflamação crônica de baixo grau e distúrbios psicológicos frequentemente observados nessas pacientes.
Para saber mais sobre o impacto do Canabidiol na qualidade de vida acesse: Impacto do Canabidiol na qualidade de vida – WeCann Academy
Um estudo clínico aberto conduzido por Sathyapalan et al. (2017) avaliou os efeitos do bloqueio do receptor CB1 com rimonabanto em 20 mulheres obesas com SOP. Embora os pesquisadores tenham inicialmente hipotetizado que o antagonismo de CB1 reduziria a inflamação e a neovascularização, os resultados demonstraram um aumento inesperado nos níveis de citocinas pró-inflamatórias, como a IL-8, além de um incremento na expressão do fator de crescimento endotelial vascular (VEGF), um marcador de angiogênese. Esses achados sugerem que a ativação do receptor CB1, ao invés de sua inibição, pode modular positivamente processos metabólicos e inflamatórios na SOP.10
Assim, o Δ9-tetraidrocanabinol (THC), um agonista parcial de CB1, poderia ter um papel terapêutico no manejo da inflamação e dos desequilíbrios metabólicos dessa condição, tornando-se um alvo farmacológico potencial para futuras investigações.10
Adicionalmente, uma linha promissora de investigação envolve a oleoiletanolamida (OEA), um análogo endocanabinoide-like que ativa receptores PPAR-α e interage com vias metabólicas e inflamatórias críticas na SOP. Em um ensaio clínico duplo-cego e controlado por placebo, a suplementação com 125 mg/dia de OEA por oito semanas promoveu melhora significativa nos marcadores glicêmicos (redução de FBS, insulina e HOMA-IR), inflamatórios (diminuição de PCR e TNF-α), de estresse oxidativo (queda no MDA e aumento do TAC) e hormonais (redução dos níveis de hormônio anti-Mülleriano – AMH). Esses efeitos são de particular interesse, uma vez que altos níveis de AMH estão fortemente associados à anovulação e ao acúmulo folicular típico da SOP.11
Os mecanismos subjacentes aos efeitos da OEA parecem estar relacionados à ativação do PPAR-α, à modulação da via inflamatória NF-κB e à regulação positiva de enzimas antioxidantes, como SOD e catalase. A redução dos níveis de AMH, em especial, é relevante, considerando que esse hormônio está associado ao acúmulo folicular e à disfunção ovulatória característica da SOP.11
Embora estudos sobre a administração combinada de THC e CBD não tenham demonstrado efeitos consistentes nos níveis plasmáticos de endocanabinoides como AEA, 2-AG e OEA em humanos, é possível que essa ausência de efeito esteja relacionada às doses utilizadas, via de administração ou frequência de uso. Por exemplo, doses orais elevadas de CBD (800 mg/dia) mostraram aumentar os níveis de AEA e OEA em pacientes com psicose, enquanto doses menores ou administradas por via inalatória não produziram alterações significativas.12
Importante destacar que a inalação de cannabis vaporizada contendo THC promoveu aumentos transitórios nos níveis plasmáticos de AEA, OEA e outros lipídios relacionados, reforçando a hipótese de que o THC pode modular positivamente o sistema endocanabinoide periférico, inclusive em condições como a SOP.12
Essas evidências abrem caminho para novas abordagens terapêuticas baseadas na modulação do sistema endocanabinoide e seus análogos, particularmente em contextos onde inflamação, resistência à insulina e disfunções reprodutivas coexistem, como na SOP.
Conclusão
A relação entre o sistema endocanabinoide e a SOP abre novas possibilidades terapêuticas para o manejo dessa condição complexa. Os canabinoides, como o CBD, apresentam potencial para modular processos inflamatórios, melhorar a sensibilidade à insulina e influenciar o eixo hipotálamo-hipófise-ovariano. Embora os estudos ainda estejam em estágios preliminares, as evidências atuais sugerem que a cannabis medicinal pode representar uma abordagem complementar promissora para pacientes que enfrentam dificuldades com os tratamentos convencionais.
Para que a incorporação da Cannabis na prática clínica ocorra de forma segura e eficaz, é essencial que os médicos tenham acesso a informações atualizadas e baseadas em evidências científicas. Nesse contexto, a Comunidade da WeCann Academy se destaca como um espaço fundamental para essa atualização, oferecendo uma rede global de profissionais altamente capacitados. Nesse ambiente colaborativo, os médicos e acadêmicos trocam conhecimentos, discutem casos clínicos desafiadores e exploram novas estratégias terapêuticas, garantindo que estejam sempre preparados para implementar as abordagens mais eficazes no tratamento com cannabis medicinal.
Além disso, a WeCann se destaca pela sua estrutura educativa, oferecendo ferramentas práticas e recursos de fácil acesso. As “WeCann Talks” e os “WeCann Rounds” proporcionam discussões dinâmicas sobre os mais recentes protocolos de tratamento, permitindo que os médicos compartilhem insights e tirem dúvidas diretamente com especialistas de renome. O aplicativo da WeCann garante que a educação e o networking possam ser acessados a qualquer hora e de qualquer lugar, promovendo uma verdadeira revolução no ensino médico. Ao fazer parte dessa comunidade, os médicos não só aprimoram suas habilidades terapêuticas, mas também garantem que seus pacientes recebam cuidados mais personalizados e eficazes.
Referências
- Síndrome dos ovários policísticos. 3a ed. — São Paulo: Federação Brasileira das Associações de Ginecologia e Obstetrícia (FEBRASGO), 2023. (Série, Orientações e Recomendações FEBRASGO, no.1/Comissão Nacional Especializada em Ginecologia Endócrina). 140p.
- MONTAGNER, Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Walker, O’Llenecia S et al. “The role of the endocannabinoid system in female reproductive tissues.” Journal of ovarian research vol. 12,1 3. 15 Jan. 2019, doi:10.1186/s13048-018-0478-9
- Gammon CM, Freeman GM, Xie W, Petersen SL, Wetsel WC. Regulation of gonadotropin-releasing hormone secretion by cannabinoids. Endocrinology. 2005;146(10):4491–4499. doi: 10.1210/en.2004-1672.
- Scorticati C, Fernández-Solari J, De Laurentiis A, Mohn C, Prestifilippo JP, Lasaga M, Seilicovich A, Billi S, Franchi A, McCann SM, Rettori V. The inhibitory effect of anandamide on luteinizing hormone-releasing hormone secretion is reversed by estrogen. Proc Natl Acad Sci U S A. 2004 Aug 10;101(32):11891-6. doi: 10.1073/pnas.0404366101. Epub 2004 Jul 27. PMID: 15280536; PMCID: PMC511070.
- El-Talatini MR, Taylor AH, Elson JC, Brown L, Davidson AC, Konje JC. Localisation and function of the endocannabinoid system in the human ovary. PLoS One. 2009;4(2):e4579. doi: 10.1371/journal.pone.0004579
- Maccarrone M. Endocannabinoids: friends and foes of reproduction. Prog Lipid Res [Internet] 2009;48(6):344–54. Available from: 10.1016/j.plipres.2009.07.001
- Cui N, Yang Y, Xu Y, Zhang J, Jiang L, Hao G. Decreased expression of fatty acid amide hydrolase in women with polycystic ovary syndrome. Gynecol Endocrinol. 2017 May;33(5):368-372. doi: 10.1080/09513590.2016.1269742. Epub 2017 Jan 28. PMID: 28132572.
- Cui N, Feng X, Zhao Z, Zhang J, Xu Y, Wang L, et al. Restored plasma anandamide and endometrial expression of fatty acid amide hydrolase in women with polycystic ovary syndrome by the combination use of Diane-35 and metformin. Clin Ther [Internet] 2017;39(4):751–8. Available from: 10.1016/j.clinthera.2017.02.007
- Sathyapalan, T., Javed, Z., Kilpatrick, E. S., Coady, A.-M, & Atkin, S. L. Endocannabinoid receptor blockade increases vascular endothelial growth factor and inflammatory markers in obese womenwith polycystic ovary syndrome. Clin. Endocrinol. (Oaf.) 86, 384-387 (2017)
- Shivyari, Fatemeh Taghizadeh et al. “Examining the oleoylethanolamide supplement effects on glycemic status, oxidative stress, inflammation, and anti-mullerian hormone in polycystic ovary syndrome.” Journal of ovarian research vol. 17,1 111. 22 May. 2024, doi:10.1186/s13048-024-01432-1
- Chester, L. A., Englund, A., Chesney, E., Oliver, D., Wilson, J., Sovi, S., Dickens, A. M., Oresic, M., Linderman, T., Hodsoll, J., Minichino, A., Strang, J., Murray, R. M., Freeman, T. P., & McGuire, P. (2024). Effects of Cannabidiol and Delta-9-Tetrahydrocannabinol on Plasma Endocannabinoid Levels in Healthy Volunteers: A Randomized Double-Blind Four-Arm Crossover Study. Cannabis and Cannabinoid Research, 9(1), 188–198.
