As doenças inflamatórias intestinais (DIIs), incluindo a Doença de Crohn e a Retocolite Ulcerativa, além da Síndrome do Intestino Irritável (SII), representam um desafio significativo para a saúde pública, afetando milhões de indivíduos em todo o mundo. O manejo dessas condições é frequentemente realizado por meio de tratamentos convencionais, que incluem medicamentos anti-inflamatórios, imunossupressores e terapias biológicas. No entanto, essas abordagens podem apresentar limitações em relação à eficácia e à ocorrência de efeitos colaterais indesejados, levando à busca por alternativas terapêuticas.
Nesse contexto, a cannabis tem ganhado destaque como uma opção promissora, devido às suas reconhecidas propriedades anti-inflamatórias, analgésicas e moduladoras do sistema gastrointestinal, oferecendo uma perspectiva inovadora para o manejo das DIIs e da SII. No post de hoje iremos explorar o potencial da Cannabis no tratamento da DII e SII.
Veja nessa postagem
Doença Inflamatória Intestinal e Síndrome do Intestino Irritável
A Doença Inflamatória Intestinal (DII) representa um desafio significativo no âmbito da gastroenterologia, caracterizando-se como uma condição crônica complexa e multifatorial. Essa enfermidade se manifesta predominantemente sob duas formas clínicas: a Doença de Crohn (DC) e a Retocolite Ulcerativa (RCU). Ambas as condições são marcadas por uma inflamação crônica no trato gastrointestinal, resultando em sintomas debilitantes, como dor abdominal intensa, inchaço, diarreia sanguinolenta recorrente, fadiga e perda de peso involuntária.
Enquanto a RCU tem uma predileção por acometer o cólon e o reto, a DC é mais insidiosa, podendo afetar qualquer segmento do trato gastrointestinal, da boca ao ânus, embora frequentemente se apresente no intestino delgado. Em ambos os casos, a inflamação intensa do epitélio gastrointestinal é uma característica central, frequentemente acompanhada pela formação de úlceras na mucosa intestinal, responsáveis pelo sangramento, pus e muco que podem ser encontrados nas fezes.1,2
As causas subjacentes da DII ainda permanecem em grande parte obscuras. Contudo, é amplamente reconhecido que uma resposta inflamatória autoimune disfuncional desempenha um papel fundamental em sua patogênese. Essa resposta é influenciada por uma complexa interação entre fatores genéticos predisponentes e elementos ambientais, como infecções intestinais prévias, que podem facilitar o desenvolvimento da doença. Essa interrelação sugere que a DII é o resultado de uma convergência entre a genética do indivíduo e seu ambiente, refletindo a complexidade dessa condição multifatorial.
Em contraste, a Síndrome do Intestino Irritável é um distúrbio funcional que também afeta o trato gastrointestinal, apresentando um conjunto de sintomas que incluem dor abdominal, cólicas, inchaço e variações nos hábitos intestinais, como diarreia ou constipação. Diferentemente da Doença Inflamatória Intestinal, a SII é caracterizada por sua natureza flutuante, onde os sintomas aparecem e desaparecem em ciclos, podendo persistir por dias, semanas ou até meses. Uma característica importante a ser observada é que, na SII, não há evidências de danos nas paredes intestinais, como as úlceras típicas observadas na DII, embora a presença ocasional de muco esbranquiçado nas fezes possa ocorrer.
As causas da SII ainda não são completamente elucidadas, mas uma variedade de fatores parece desempenhar um papel em sua manifestação. Estresse emocional, distúrbios de saúde mental, hábitos alimentares inadequados e alterações no microbioma gastrointestinal têm sido implicados como potenciais contribuintes para o desenvolvimento dessa condição. Essa complexidade evidencia a necessidade de uma abordagem multifacetada para o diagnóstico e manejo da SII, considerando tanto os aspectos físicos, quanto emocionais que podem influenciar a saúde intestinal do paciente.
O diagnóstico da Doença Inflamatória Intestinal geralmente requer uma combinação de avaliações clínicas, endoscópicas e laboratoriais. Em contrapartida, a identificação da Síndrome do Intestino Irritável é realizada com base na anamnese clínica e nos critérios de Roma, dispensando a necessidade de procedimentos invasivos.
O tratamento convencional da DII envolve mudanças na dieta e no estilo de vida, além do uso de medicamentos ou cirurgia em casos mais severos. A terapia farmacológica frequentemente inclui imunossupressores, que têm como objetivo induzir e manter a remissão da doença. No entanto, as opções atuais de imunossupressão apresentam limitações significativas.1,2 Esses medicamentos podem perder rapidamente a eficácia e acarretar riscos a longo prazo, como a predisposição a infecções, diminuição da densidade óssea e aumento do risco de malignidade. Além disso, os altos custos associados a esses tratamentos impõem um desafio adicional aos sistemas de saúde.3,4
Essas limitações ressaltam a necessidade urgente de desenvolver abordagens terapêuticas mais seguras e eficazes, tanto para o controle da DII quanto para o manejo da SII. Nesse contexto, a cannabis tem emergido como uma alternativa promissora. Seus compostos, como os canabinoides, demonstram propriedades anti-inflamatórias, analgésicas e moduladoras do sistema gastrointestinal, sugerindo que possam oferecer alívio significativo dos sintomas associados a essas condições.
Estudos recentes têm explorado a eficácia da cannabis na redução da inflamação intestinal e na melhora da qualidade de vida dos pacientes, indicando que essa abordagem terapêutica poderia complementar ou até substituir as opções convencionais em determinados casos. Essa busca por novas alternativas não só visa otimizar o tratamento, mas também oferece uma esperança renovada para pacientes que lidam com as complexidades da DII e da SII.
Sistema Endocanabinoide na DII e SII
O sistema endocanabinoide (SEC) é um componente fundamental na regulação da fisiologia gastrointestinal, tendo sua expressão detectada em diversos tipos celulares, incluindo neurônios do plexo mioentérico, fibras aferentes do nervo vago, enterócitos e células enteroendócrinas. Essa ampla distribuição sugere uma função abrangente do SEC na modulação de processos essenciais, como a percepção da dor visceral, a motilidade intestinal, a secreção hormonal, a permeabilidade do epitélio intestinal, a absorção de nutrientes e a resposta imune. Essas funções estão intimamente relacionadas aos mecanismos fisiopatológicos observados em distúrbios gastrointestinais, particularmente na DII e na SII. A modulação farmacológica do SEC, portanto, emerge como uma estratégia terapêutica promissora para o manejo clínico dessas condições.5
Estudos científicos têm elucidado os papéis funcionais do SEC na fisiopatologia da DII. Os receptores canabinoides CB1 e CB2, cuja expressão aumenta durante o curso da doença, exercem efeitos protetores notáveis. Evidências demonstram que intervenções, seja por meio de manipulação genética ou inibição farmacológica desses receptores, podem resultar na piora dos parâmetros inflamatórios e histopatológicos. Isso reforça o papel crucial desses receptores na modulação da inflamação intestinal.6
Adicionalmente, o aumento da atividade dos receptores canabinoides, seja por agonistas sintéticos ou pela inibição da degradação dos endocanabinoides como a anandamida e o 2-AG, desencadeia efeitos anti-inflamatórios significativos. Esses efeitos incluem a redução da produção de citocinas pró-inflamatórias e a modulação da resposta imune celular. Em modelos experimentais de DII, a administração de tetrahidrocanabinol (THC) e canabidiol (CBD) demonstrou não apenas a diminuição das citocinas inflamatórias, mas também a capacidade de conferir propriedades antioxidantes, afetar a atividade dos neurônios entéricos e regular a permeabilidade intestinal. Essa combinação de ações resulta na atenuação da resposta inflamatória e na melhoria dos sintomas clínicos, além de retardar a progressão da DII.6
Além do THC e do CBD, outros fitocanabinoides, como o ácido tetrahidrocanabinólico (THCA) e o canabigerol (CBG), têm mostrado potencial terapêutico no contexto da DII. O THCA, por exemplo, exerce sua ação anti-inflamatória através da ativação dos receptores GPR55 em células epiteliais do cólon, enquanto o CBG demonstrou propriedades anti-inflamatórias e antioxidantes em modelos murinos de DII, interagindo principalmente com os receptores CB2. Essas descobertas destacam que canabinoides menos conhecidos, como o THCA e o CBG, podem abrir novas possibilidades terapêuticas para a DII.7,8
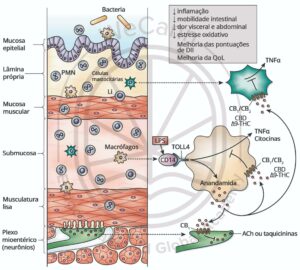
Na SII, a ativação dos receptores vaniloides TRPV1 foi implicada na fisiopatologia da doença. Biópsias de pacientes com SII revelaram um aumento significativo das fibras nervosas imunorreativas ao TRPV1, o que pode contribuir para as características de dor e hipersensibilidade visceral frequentemente relatadas. A ativação sustentada dos receptores TRPV1 por agonistas resulta em dessensibilização, um mecanismo que se relaciona ao potencial analgésico de canabinoides não psicotrópicos, como o CBD e o canabidivarina (CBDV), que atuam como agonistas nos receptores TRPV1.9
Um estudo demonstrou que os níveis de anandamida estão significativamente diminuídos na mucosa intestinal inflamada de pacientes com DII, em comparação com áreas não afetadas. Essa diminuição foi correlacionada à redução da atividade da NAPE-PLD (N-acil-fosfatidiletanolamina-fosfolipase D), uma enzima crucial para a biossíntese da anandamida, enquanto se observou um aumento na atividade da FAAH (Fatty Acid Amide Hydrolase), a enzima responsável pela degradação da anandamida. Esses achados sugerem um desequilíbrio na sinalização canabinoide que pode contribuir para a patogênese da DII, enfatizando a necessidade de uma modulação adequada do sistema endocanabinoide para restaurar a homeostase intestinal.10
Estudos mais recentes, como o de Strisciuglio et al. (2023), ressaltam a elevada expressão dos receptores canabinoides CB2 na mucosa intestinal inflamada de pacientes pediátricos com DII. Essa abundância reforça a hipótese de que a ativação dos receptores CB2 pode exercer efeitos protetores e anti-inflamatórios significativos, posicionando o SEC como um alvo terapêutico de relevância no tratamento da DII.11
No contexto da SII, esta condição foi proposta como uma manifestação da Deficiência Endocanabinoide Clínica (DEC), caracterizada por um SEC hipoativo. A interconexão observada entre SII, enxaqueca e fibromialgia sugere a presença de um espectro comum de disfunção do sistema endocanabinoide, onde os pacientes frequentemente experimentam sintomas que refletem essa desregulação. A ativação do SEC mostrou potencial para atenuar a inflamação e o estresse oxidativo na parede gastrointestinal, além de regular o eixo hipotálamo-hipófise-adrenal (HPA), que é vital na resposta ao estresse, e influenciar a composição da microbiota intestinal, um fator crítico na saúde gastrointestinal.
O sistema endocanabinoide não se configura apenas como um alvo terapêutico promissor para as condições de DII e SII, mas também como um componente essencial para um entendimento mais abrangente da homeostase gastrointestinal. A modulação deste sistema pode não apenas melhorar a funcionalidade intestinal, mas também contribuir de forma significativa para a redução da inflamação e do desconforto abdominal, levando a um impacto positivo na qualidade de vida dos pacientes.
Para saber mais sobre o Sistema Endocanabinoide acesse: O que é o Sistema Endocanabinoide?
Estudos Científicos
Um dos primeiros ECRs, realizado nos Estados Unidos em 2007, examinou o uso do tetrahidrocanabinol (THC) sintético, conhecido como dronabinol, em indivíduos saudáveis. Este estudo concluiu que a administração de 7,5 mg de dronabinol resultou no relaxamento do cólon e na diminuição da motilidade e do tônus colônico pós-prandial, além de aumentar a percepção de distensão abdominal. Esses resultados sugerem um efeito modulador central da percepção visceral pelo dronabinol, indicando seu potencial terapêutico em condições de doenças diarreicas, como a SII.12
Uma especialista em medicina interna e gastroenterologista israelense, Timna Naftali, conduziu uma série de ECRs focados na eficácia da cannabis em diversas doenças gastrointestinais, incluindo DC, RCU e SII. Em um estudo de 2013, Naftali et al. administraram cigarros de flores de cannabis contendo 115 mg de THC ou placebo, duas vezes ao dia, durante 8 semanas a 21 pacientes com DC grave, que não responderam a terapias convencionais. Os resultados mostraram que 90% dos pacientes que receberam cannabis apresentaram uma diminuição significativa nos escores do Índice de Atividade da Doença de Crohn (CDAI), enquanto apenas 40% do grupo placebo relataram melhora clínica. A remissão completa foi observada em 45% dos pacientes tratados com cannabis, em comparação com 10% no grupo placebo.13
Além disso, outros ensaios clínicos randomizados realizados por Naftali et al. indicaram que a terapia com cannabis pode induzir remissão clínica em pacientes com retocolite ulcerativa e doença de Crohn, embora a remissão endoscópica, que avalia diretamente a inflamação da mucosa intestinal, não tenha sido alcançada. Em um estudo publicado em 2021, 32 pacientes com RCU foram tratados com cigarros contendo 80 mg de THC. Os resultados mostraram uma melhoria significativa nos sintomas clínicos dos pacientes, como a redução da dor abdominal e da frequência de evacuações, em comparação ao grupo placebo. No entanto, apesar dessas melhorias sintomáticas, os escores endoscópicos e os marcadores laboratoriais de inflamação, permaneceram inalterados, sugerindo que o efeito da cannabis foi predominantemente sintomático.14
Em outro estudo de Naftali et al. (2021b), o efeito do óleo de cannabis, contendo uma formulação com 16% de CBD e 4% de THC, foi avaliado em 56 pacientes com DC. O tratamento sublingual com o óleo resultou em melhorias significativas na qualidade de vida dos pacientes, medida por questionários padronizados como o índice de atividade da doença de Crohn (CDAI). Além disso, observou-se uma redução na necessidade de uso de corticosteroides e outros imunossupressores. Contudo, de forma semelhante ao estudo anterior, não houve mudanças notáveis nos marcadores inflamatórios sistêmicos e nem nos achados endoscópicos. Isso reforça a hipótese de que os benefícios da cannabis possam estar mais relacionados ao alívio de sintomas do que a um efeito direto na inflamação intestinal subjacente.15
Além dos canabinoides, a palmitoiletanolamida (PEA), um composto com propriedades semelhantes aos endocanabinoides, tem ganhado atenção como uma intervenção terapêutica promissora para condições gastrointestinais como a DII e a SII. Em um estudo conduzido por Cremon et al. (2017), a administração de PEA mostrou uma redução significativa na dor abdominal em pacientes com SII, embora os biomarcadores biológicos da doença não tenham sofrido alterações expressivas. Isso sugere que o efeito da PEA está mais relacionado ao alívio da dor do que à modificação direta do processo inflamatório ou da patologia subjacente.16
De maneira complementar, Couch et al. (2019) investigaram o impacto do CBD e da PEA sobre a permeabilidade intestinal, uma característica central de várias doenças intestinais. Os resultados indicaram que ambos os compostos reduziram a permeabilidade da mucosa intestinal em humanos, o que pode representar um benefício importante no tratamento de doenças associadas a alterações na barreira intestinal, como a DII e a SII. Esses achados sugerem que o CBD e a PEA podem contribuir para a restauração da integridade intestinal, fornecendo uma camada adicional de proteção contra danos inflamatórios e infecciosos.17
Recentemente, um ensaio clínico randomizado (ECR) de fase II, liderado por Chang et al. (2023), avaliou a eficácia e segurança do olorinabe, um agonista sintético dos receptores canabinoides CB2, em pacientes com SII. Embora o olorinabe tenha sido bem tolerado em todas as doses testadas, apenas a dose mais alta (50 mg) demonstrou uma melhora significativa na redução da dor abdominal. Esses resultados sugerem que a ativação dos receptores CB2 pode ter um papel promissor no manejo da dor associada à SII, especialmente em doses mais elevadas, ressaltando a necessidade de estudos adicionais para determinar a dose ideal e explorar seu potencial terapêutico de maneira mais ampla.18
Conclusão
A cannabis, através de seus compostos bioativos, como o THC e o CBD, emerge como uma alternativa promissora no tratamento da Doença Inflamatória Intestinal e da Síndrome do Intestino Irritável. Sua capacidade de modular o sistema endocanabinoide e exercer efeitos anti-inflamatórios, analgésicos e antioxidantes oferece um novo horizonte terapêutico, especialmente para pacientes que não respondem bem aos tratamentos convencionais. Embora mais estudos clínicos sejam necessários para consolidar a eficácia e segurança de longo prazo da cannabis nessas condições, as evidências atuais sugerem um potencial significativo no manejo da inflamação intestinal e na melhoria da qualidade de vida dos pacientes.
Nesse cenário, é essencial que os médicos permaneçam atualizados sobre os avanços no uso terapêutico da cannabis medicinal, garantindo a melhor abordagem para seus pacientes. A WeCann desempenha um papel vital ao fornecer conteúdos técnicos de alta qualidade sobre cannabis medicinal, baseados em rigor científico. Dessa forma, a WeCann facilita a incorporação segura da cannabis na prática clínica, promovendo uma abordagem eficaz e personalizada para pacientes com condições crônicas, refratárias e incapacitantes.
Referências
- Torres, J. et al. ECCO Guidelines on Therapeutics in Crohn’s Disease: Medical Treatment. J. Crobns Colitis 14, 4-22 (2020).
- Leinwand, K, L., Gerich, M. E, Hoffenberg, E.J. & Collins, C.B. Manipulation of the Endocannabinoid System in Colitis: A Comprehensive Review. Inflamm. Bowel Dis. 23, 192-199 (2017).
- Carvalho, A. C.A.D.et al. Cannabisand Canabidinoids on the Inflammatory Bowel Diseases: Going Beyond Misuse. Int.J. Mol. Sci. 21, 2940 (2020).
- Hirschmann, S & Neurath, M. F. Top-down approach to biological therapy of Crohn’s disease. Expert Opin. Biol. Ther. 17, 285-293 (2017).
- Sharkey, K. A. & Wiley, J. W. The Role of the Endocannabinoid System in the Brain-Gut Axis. Gastroenterology 151,252-266 (2016).
- Hryhorowicz, S. et al Endocannabinoid System as a Bowel Disease A Systematic Review. Front. Promising Therapeutic Target in Inflammatory Immunol. 12, 790803 (2021).
- Nallathambi, R. et al. Anti-Inflammatory Activity in Colon Models Is Derived from 49- Tetrahydrocannabinolic Acid That Interacts with Additional Compounds in Cannabis Extracts Cannabis Cannabinoid Res. 2, 167-182 (2017).
- Borrelli, F. et al. Beneficial effect of the non-psychotropic plant cannabinoid cannabigerol on experimental inflammatory bowel disease. Biochem Pharmacol. 85, 1306-1316 (2013).
- Akbar, A. et al. Increased capsaicin receptor TRPV1 expressing sensory fibres in irritable bowel syndrome and their correlation with abdominal pain. Gut 57, 923-929 (2008).
- Di Sabatino, A. et al. The endogenous cannabinoid system in the gut of patients with inflammatory bowel disease. Mucosal Immunol. 4, 574-583 (2011).
- Strisciuglio, C. et al. Increased expression of CB2 receptor in the intestinal biopsies of children with inflammatory bowel disease, Pediatr; Res. 93, 520-525 (2023).
- Esfandyari, T.et al. Effects of a cannabinoid receptor agonist on colonic motor and sensory functions in humans: a randomized, placebo-controlled study. Am. J. Physiol.-Gastrointest. Liver Physiol. 293, G137-G145 (2007).
- Naftali, T. et al Cannabis Induces Clinical a Response in Patients with Crohn’s Disease: a Prospective Placebo-Controlled Study. Clin. Gastroenterol. Hepatol. 19 (2013).
- Naftali, T. et al. Cannabis is associated with clinical but not endoscopic remission in ulcerative colitis: A randomized controlled trial. PLOS ONE 16, e0246871 (2021).
- Naftali, T, Bar-Lev Schleider, L., Almog,S., Meiri, D. & Konikoff,F M. Oral CBD-rich Cannabis Induces Clinical but Not Endoscopic Response in Patients with Crohn’s Disease, a Randomised Controlled Trial. J. Crobns Colitis 15, 1799-1806 (2021).
- Cremon, C. et al. Randomised clinical trial: the analgesic properties of dictary supplementation with palmitoylethanolamide and polydatin in irritable bowel syndrome. Aliment. Pharmacol, Ther 45, 909-922 (2017).
- Couch, D, G. et al. Palmitoylethanolamide and Cannabidiol Prevent Inflammation-induced Hyperpermeability of the Human Gut In Vitro and In Vivo–A Randomized, Placebo-controlled, Double-blind Controlled Trial. Inflamm. Bowel Dis. 25, 1006-1018 (2019)
- Chang, L. et al, Efficacy and safety of olorinab, a ful agonist of the cannabinoid receptor 2, for the treatment of abdominal pain in patients with irritable bowel syndrome: Results from a phase 2b randomized placebo-controlled trial (CAPTIVATE). Neurogastroenterol. Motil. 35, e14539 (2023).
