O Transtorno por Uso de Cannabis (TUC) é uma condição psiquiátrica formalmente reconhecida, descrita pela primeira vez no Manual Diagnóstico e Estatístico de Transtornos Mentais, Quinta Edição (DSM-5). Anteriormente, o uso problemático de cannabis era dividido entre abuso e dependência, mas o DSM-5 consolidou esses quadros em uma única categoria, refletindo a complexidade do uso compulsivo da substância. Estima-se que até 10% dos aproximadamente 193 milhões de usuários de cannabis no mundo sofram de algum grau de TUC, caracterizado pela dificuldade em controlar o consumo, aumento da tolerância e sintomas de abstinência quando o uso é interrompido.¹ Importante destacar que esse transtorno não se limita à dependência química, e que mesmo sem sinais claros de vício, o uso inapropriado da cannabis pode gerar impactos significativos na vida dos usuários.
O paradoxo no tratamento do TUC com a própria planta de cannabis surge do conhecimento crescente sobre os diversos compostos ativos da planta, como o canabidiol (CBD) e o Δ9-tetraidrocanabinol (Δ9-THC). Já existem diversas comprovações científicas do uso desses compostos presentes na cannabis no tratamento de diversas condições médicas. No post de hoje vamos explorar o potencial terapêutico da cannabis, no manejo do TUC, abordando suas possíveis implicações no tratamento da dependência e seus efeitos no sistema endocanabinoide.
Veja nessa postagem
Transtorno por uso de Cannabis
O Transtorno por Uso de Cannabis (TUC) é uma condição psiquiátrica caracterizada pelo uso problemático e persistente da cannabis, levando a prejuízos funcionais e sofrimento significativo. Segundo o DSM-5, o TUC abrange um espectro de comportamentos compulsivos relacionados ao consumo da substância, substituindo as categorias anteriormente conhecidas como abuso e dependência de cannabis. A condição é diagnosticada com base em critérios clínicos que avaliam o impacto do uso da cannabis na vida do indivíduo, como a perda de controle sobre o consumo, aumento da tolerância, e a ocorrência de sintomas de abstinência após a interrupção do uso.
O DSM-5 define o TUC como um padrão de comportamento que leva a um comprometimento ou sofrimento clinicamente significativo, manifestado em um período de 12 meses. Esse transtorno é caracterizado pela presença de pelo menos dois dos seguintes critérios: o uso de cannabis ocorre em quantidades maiores ou por um período mais prolongado do que o planejado; há um desejo persistente de reduzir o uso, mas com tentativas malsucedidas; um tempo excessivo é gasto na aquisição, uso ou recuperação dos efeitos da substância; ocorrem desejos intensos de utilizar cannabis; o uso repetido resulta na negligência de obrigações sociais; e o consumo continua, mesmo diante de problemas sociais ou interpessoais. Adicionalmente, o indivíduo pode renunciar a atividades sociais, ocupacionais ou recreativas importantes para usar cannabis, e persistir no uso apesar de danos físicos ou problemas psicológicos relacionados. A tolerância e os sintomas de abstinência quando a substância não é utilizada também são critérios importantes para o diagnóstico, ressaltando a gravidade do transtorno e a necessidade de intervenções adequadas.²
Os indivíduos com TUC frequentemente enfrentam compromissos sociais e ocupacionais, com dificuldades que se manifestam em suas vidas familiares, acadêmicas e profissionais. A negligência de obrigações pode resultar em desempenho insatisfatório e conflitos interpessoais. Além disso, o TUC está frequentemente associado a comorbidades, como depressão, ansiedade e transtorno de estresse pós-traumático (TEPT), onde o uso recreativo crônico e indiscriminado de cannabis pode agravar esses transtornos ou levar ao desenvolvimento de novos problemas psiquiátricos.³
O tratamento do TUC pode variar conforme a gravidade dos sintomas e a presença de comorbidades. As terapias comportamentais desempenham um papel crucial, com abordagens como a Terapia Cognitivo-Comportamental (TCC), que ajuda os indivíduos a identificar e modificar padrões de pensamento e comportamento que sustentam o uso problemático da cannabis. A TCC também ensina habilidades de enfrentamento para lidar com situações que podem desencadear o uso da substância. A Terapia de Aprimoramento Motivacional é outra abordagem útil, visando aumentar a motivação do paciente para mudar seus comportamentos, ajudando-o a explorar as razões para a mudança e a definir metas concretas. O gerenciamento de contingência é um método baseado em recompensas, onde os pacientes recebem incentivos por atingirem metas de abstinência ou redução do uso de cannabis.
Além das terapias convencionais, a discussão sobre o uso da própria cannabis como forma de tratamento para o TUC tem ganhado espaço. Alguns estudos sugerem que o uso controlado de cannabis em formulações para via de administração oral ou sublingual, com menor teor de THC, ou a administração de canabinoides não psicotrópicos, como o canabidiol (CBD), pode ajudar a aliviar os sintomas de abstinência e reduzir o desejo por cannabis em alguns indivíduos.
Sistema endocanabinoide e TUC
O sistema endocanabinoide (SEC) tem um papel fundamental na regulação dos circuitos cerebrais envolvidos nos mecanismos de recompensa, diretamente ligados ao desenvolvimento de transtornos por uso de substâncias, como o transtorno por uso de cannabis (TUC). O SEC é composto por endocanabinoides, receptores (CB1 e CB2), e enzimas, sendo responsável por manter o equilíbrio de diversas funções cerebrais. Quando há desregulação desse sistema, especialmente pelo uso contínuo de substâncias como a cannabis, pode ocorrer o desenvolvimento de dependência.4
O sistema de recompensa do cérebro, conhecido como via mesocorticolímbica, é crucial para o reforço positivo de atividades que proporcionam prazer. Esse circuito inclui áreas como a área tegmental ventral (VTA), onde neurotransmissores como dopamina, glutamato e GABA são predominantes. A ativação dos receptores CB1 na VTA, promovida pelo THC, principal componente psicotrópico da cannabis, reduz a liberação de GABA, levando à desinibição dos neurônios dopaminérgicos e, consequentemente, ao aumento da dopamina nessa via. Esse aumento da dopamina intensifica o circuito de recompensa, reforçando a sensação de prazer e promovendo o uso repetido da substância, o que pode evoluir para dependência.5
O canabidiol, um componente não psicotrópico da cannabis, tem se mostrado promissor como agente terapêutico para o manejo do TUC. Ao contrário do THC, o CBD não ativa os receptores CB1 de forma a provocar os efeitos de reforço da dependência. Pelo contrário, o CBD atua como um modulador alostérico negativo, ou seja, ele reduz a ação do THC nos receptores CB1, diminuindo a ativação exacerbada do sistema de recompensa. Isso faz com que o CBD seja estudado como uma opção terapêutica eficaz para o tratamento de transtornos por uso de cannabis.6
Além de seus efeitos no sistema endocanabinoide, o CBD parece influenciar outros sistemas neurais envolvidos na dependência, como os receptores de serotonina (5-HT1a) e dopamina (D2), contribuindo para a redução de comportamentos compulsivos e ansiosos associados ao uso de substâncias. Sua ação ansiolítica e antipsicótica tem sido observada em vários estudos pré-clínicos e clínicos, reforçando seu potencial para tratar o TUC e outras formas de dependência.7
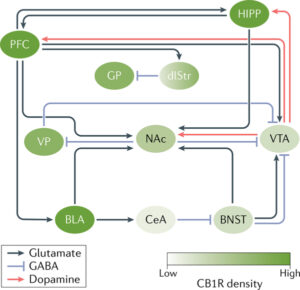
A exposição aguda aos canabinoides desencadeia uma cascata neuroquímica que envolve projeções dopaminérgicas da área tegmental ventral para o núcleo accumbens (NAc), um componente central na codificação da recompensa e no comportamento de consumo. O VTA também envia projeções dopaminérgicas ao hipocampo (HIPP) e ao córtex pré-frontal (PFC), modulando processos como memória, aprendizado associativo e tomada de decisão. Paralelamente, o NAc recebe inervações glutamatérgicas do PFC, da amígdala basolateral (BLA), do HIPP e do núcleo do leito da estria terminal (BNST), que reforçam a integração de sinais relacionados ao medo e à recompensa.8
A regulação da atividade dopaminérgica é mediada por neurônios GABAérgicos localizados no VTA e por projeções GABAérgicas que conectam o NAc ao VTA, tanto diretamente quanto via pálido ventral (VP). Essas interações contribuem para a modulação precisa de estímulos aversivos e recompensadores, permitindo a execução de comportamentos cognitivos e afetivos complexos. Esse entendimento ressalta os desafios neurobiológicos no manejo do transtorno por uso de cannabis, evidenciando a complexidade do sistema endocanabinoide na regulação do circuito de recompensa e suas interconexões.8
Em resumo, o sistema endocanabinoide está diretamente envolvido na formação e manutenção do TUC. O uso de cannabis ativa intensamente o SEC, principalmente por meio do THC, o que leva ao reforço do uso e ao desenvolvimento da dependência. No entanto, a modulação desse sistema, especialmente com o uso de CBD, surge como uma abordagem promissora para o tratamento do transtorno por uso de cannabis, oferecendo uma possível alternativa terapêutica que reduz os efeitos adversos do THC e ajuda no controle dos sintomas de dependência.
Para saber mais sobre os mecanismos envolvidos no sistema endocanabinoide e no transtorno por uso de substâncias acesse: Canabidiol no tratamento dos Transtornos por Uso de Substâncias – WeCann Academy
Evidências Científicas
Nos últimos anos, a pesquisa científica tem avançado significativamente em busca de tratamentos eficazes para o transtorno por uso de cannabis, refletindo a necessidade crescente de manejo adequado dessa condição. Alguns ensaios clínicos randomizados (ECRs) duplo-cegos, avaliaram o papel de diferentes canabinoides no tratamento do TUC. Os resultados, embora variados, trouxeram insights promissores sobre o uso terapêutico dessas substâncias.
Estudos com THC, mostraram efeitos positivos no alívio dos sintomas de abstinência em pacientes com TUC. Três ensaios clínicos exploraram doses de THC entre 30 mg e 90 mg por dia durante períodos de 5 a 7 dias, observando uma redução significativa na gravidade da abstinência e na fissura por cannabis, em comparação com o placebo. No entanto, esses estudos tiveram amostras pequenas, limitando o impacto estatístico dos resultados.9,10, 11
Além do THC, o dronabinol, uma formulação sintética oral do THC, também foi investigado. Em três ECRs, com doses de 30 mg a 120 mg ao dia, os resultados indicaram uma diminuição dose-dependente nos sintomas de abstinência, embora os efeitos sobre a manutenção da abstinência e a redução do consumo de cannabis tenham sido menos consistentes. Mesmo com as limitações dos estudos, essas pesquisas sugerem que tanto o THC quanto o dronabinol podem ajudar a aliviar os sintomas associados à interrupção do uso de cannabis.12
Uma abordagem que tem gerado interesse é o uso do spray oral de nabiximols, uma combinação de THC e CBD. Até o momento, quatro ECRs analisaram sua eficácia no TUC, com doses máximas de 113,4 mg de THC e 105 mg de CBD, administradas por até 12 semanas. Os resultados apontaram para uma redução significativa na gravidade da abstinência e no consumo de cannabis na maioria dos estudos. Esse tratamento combinado parece promissor, especialmente quando associado a programas de aconselhamento e suporte terapêutico.13
O CBD também tem atraído atenção no manejo do TUC. No entanto, até agora, apenas três estudos avaliaram seu impacto nesse transtorno, com base em um único ECR. O estudo conduzido por Freeman et al. (2020) mostrou que doses de 400 mg e 800 mg de CBD reduziram o uso de cannabis, evidenciado pela queda nos níveis urinários de THC-COOH e pelo aumento do tempo de abstinência semanal. Embora os efeitos cognitivos do CBD não tenham sido tão pronunciados, provavelmente, pelo curto período de 4 semanas de uso da substância, a sua segurança e eficácia em reduzir o consumo de cannabis são claras.14
Além dos canabinoides naturais, outras abordagens farmacológicas estão em desenvolvimento. O inibidor da enzima FAAH, conhecido como JZP150, mostrou-se promissor ao aumentar os níveis de anandamida, um importante endocanabinoide, impedindo sua degradação. Em um pequeno grupo de pacientes com TUC, o uso desse inibidor reduziu com segurança, tanto os sintomas de abstinência quanto o consumo de cannabis.15
Outro composto inovador, o AEF0117, um inibidor seletivo da sinalização do receptor CB1, também está sendo investigado. Em ensaios clínicos, ele demonstrou reduzir significativamente os efeitos prazerosos associados ao THC e a autoadministração de cannabis, sem induzir sintomas de abstinência, apontando para um potencial tratamento para o TUC.16
Conclusão
O TUC é uma condição psiquiátrica complexa e desafiadora. Embora o uso excessivo de cannabis possa gerar prejuízos significativos, as pesquisas atuais oferecem perspectivas promissoras para o manejo dessa condição. Tanto os canabinoides naturais, como o THC e o CBD, quanto compostos sintéticos e novas abordagens farmacológicas, como os inibidores de FAAH e CB1, têm mostrado potencial terapêutico no tratamento do TUC.
Nesse contexto, é essencial que os médicos estejam informados sobre os avanços no manejo terapêutico do transtorno por uso de cannabis para oferecerem abordagens eficazes e baseadas em evidências científicas. A WeCann desempenha um papel crucial ao fornecer conteúdo técnico de alta qualidade sobre o uso de canabinoides no tratamento do TUC, fundamentado em rigor científico. Dessa forma, a WeCann contribui para a integração segura e eficaz da cannabis medicinal na prática clínica, promovendo estratégias de tratamento mais personalizadas e assertivas para pacientes que enfrentam essa condição complexa e desafiadora.
Referências
- Connor J, Stjepanovic D, Le Foll B, Hoch E, Budney A, Hall W. Cannabis use and cannabis use disorder. Nature Rev Disease Primers. 2021;7(16). doi:10.1038/s41572-021-00247-4.
- Patel J, Marwaha R. Cannabis Use Disorder. [Updated 2024 Mar 20]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK538131/
- Amie C. Hayley, Con Stough, Luke A. Downey, DSM-5 cannabis use disorder, substance use and DSM-5 specific substance-use disorders: Evaluating comorbidity in a population-based sample, European Neuropsychopharmacology, Volume 27, Issue 8, 2017, Pages 732-743, ISSN 0924-977X, https://doi.org/10.1016/j.euroneuro.2017.06.004.
- Gardner, E. L. & Lowinson, J. H. Marijuana’s interaction with brain reward systems: Update 1991. Pharmacol. Biochem. Behav, 40, 571-580 (1991).
- MONTAGNER,Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Navarrete, F, Garcfa-Gutiérrez, M. S., Gasparyan, A., Austrich-Olivares, A. & Manzanares, J. Role of Cannabidiol in the Therapeutic Intervention for Substance Use Disorders. Front. Pbarmacol. 12, 626010 (2021).
- Paulus, V., Billieux, J., Benyamina, A. & Karila, L. Cannabidiol in the context of substance use disorder treatment: A systematic review. Addict. Bebav, 132, 107360 (2022).
- Connor, J.P., Stjepanović, D., Le Foll, B. et al. Cannabis use and cannabis use disorder. Nat Rev Dis Primers 7, 16 (2021). https://doi.org/10.1038/s41572-021-00247-4
- Haney, M. et al. Effects of THC and lofexidine in a human laboratory model of marijuana withdrawal and relapse. Psycbopbarm.acology (Berl.) 197, 157-168 (2008).
- Budney, A. J., Vandrey, R. G. Hughes, J. R., Moore, B. A. & Bahrenburg. Oral delta-9-tetrahydrocannabinol suppresses cannabis withdrawal symptoms. Drug Alcohol Depend. 86, 22-29 (2007).
- Hancy, M. et al. Marijuana Withdrawal in Humans: Effects of Oral THC or Divalproex Netropsychopbarmacology 29, 158-170 (2004).
- Levin, F. R. et al. Dronabinol and lofexidine for cannabis use disorder: A randomized, double-blind, placebo-controlled trial. Drug Alcobol Depend. 159, 53-60 (2016).
- Trigo,.J.M.etal. Eflects offixed or self-titrated dosages of Sativex on cannabis withdrawal and cravings. Drig Alcohol Depend. 161, 298-306 (2016).
- Freeman, T. P. et al. Cannabidiol for the treatment of cannabis use disorder: a phase 2a double-blind, placebo-controlled randomised, adaptive Bayesian trial. Lancet Psycbiatry 7, 865-874 (2020).
- D’Souza, D. C. et al. Efficacy and safety of a fatty acid amide hydrolase inhibitor (PF-04457845) in the treatment of cannabis withdrawal and dependence in men: a double-blind, placebo-controlled, paralle group, phase 2a single-site randomised controlled trial. Lancet Psychiatry 6, 35-45 (2019).
- Haney, M. et al. Signaling-specific inhibition of the CB1 receptor for cannabis use disorder: phase 1 and phase 2a randomized trials. Nat. Med. 29, 1487-1499 (2023).
