O câncer representa um dos maiores desafios da medicina contemporânea, caracterizando-se como um conjunto heterogêneo de patologias com alta morbidade e mortalidade. Segundo dados epidemiológicos recentes, o câncer constitui a segunda causa de morte em escala global, com aproximadamente 10 milhões de óbitos anuais. A doença neoplásica impacta significativamente os indicadores de qualidade de vida relacionados à saúde (QVRS), comprometendo diversas dimensões biopsicossociais do paciente.
Os pacientes oncológicos frequentemente experimentam diversos sintomas debilitantes, incluindo dor crônica (presente em 50-70% dos casos), caquexia (afetando 80% dos pacientes em estágio avançado), náuseas e vômitos induzidos pela quimioterapia (NVIQ), fadiga (relatada por até 90% dos pacientes), anorexia e distúrbios do sono. Além disso, os sintomas são exacerbados pelos efeitos adversos das terapias convencionais, criando um ciclo de deterioração funcional e sofrimento multidimensional.
Os impactos psicossociais incluem altas taxas de transtornos de ansiedade (48%), depressão (25-30%), isolamento social e comprometimento da capacidade laborativa. O desfecho clínico é frequentemente agravado pela resistência tumoral às terapias convencionais, levando à necessidade premente de novas abordagens terapêuticas adjuvantes ou alternativas. Diante desse cenário, o post de hoje explora os mecanismos pelos quais a cannabis pode contribuir no combate ao câncer.
Fisiopatologia do Câncer: Bases Moleculares
O câncer caracteriza-se como uma neoplasia maligna resultante da proliferação descontrolada de células que se multiplicam mesmo na ausência de fatores de crescimento, com potencial para invasão de tecidos adjacentes e formação de metástases. A carcinogênese é um processo multifatorial, influenciado por uma complexa interação entre fatores endógenos e exógenos que provocam danos ao DNA celular.
Os fatores endógenos incluem estresse genotóxico, obesidade, envelhecimento, alterações genéticas herdadas, histórico reprodutivo, disfunções imunológicas, ancestralidade/etnia, sexo biológico e desequilíbrios hormonais. Entre os fatores exógenos destacam-se radiação ionizante, raios UVA e UVB, tabagismo, padrões dietéticos inadequados, exposição a hormônios exógenos (orais ou injetáveis), infecções virais e consumo crônico de álcool. Estes agentes podem causar danos ao DNA tanto em sequências codificantes, alterando diretamente as funções celulares, quanto em regiões não codificantes.¹
Alterações genéticas fundamentais
A transformação neoplásica envolve principalmente dois tipos de alterações genéticas:
- Inativação de Genes Supressores de Tumor: Estes genes codificam proteínas responsáveis pela identificação de danos celulares, promoção de reparos e, quando necessário, indução de apoptose (morte celular programada que não desencadeia inflamação em tecidos adjacentes). O gene TP53 é o mais frequentemente mutado em tumores humanos, presente em aproximadamente 50% dos casos. Em condições normais, a proteína p53 liga-se ao DNA, identifica danos e interrompe o ciclo celular, permitindo a ativação de mecanismos de reparo. Níveis baixos de dano induzem a expressão de antioxidantes e reparo do DNA, enquanto danos extensos estimulam a geração de espécies reativas de oxigênio (ROS), desencadeando a apoptose. A Síndrome de Li-Fraumeni exemplifica como mutações hereditárias no gene TP53 podem predispor ao desenvolvimento de múltiplos tipos de câncer.¹
- Ativação de Oncogenes: São versões de proto-oncogenes que, em condições patológicas, apresentam-se superativados (ganho de função), estimulando excessivamente a proliferação celular. Os produtos destes genes podem atuar em diversos níveis: superprodução de fatores de crescimento, hipersensibilização de receptores, alteração em moléculas de transdução de sinal, modificação de fatores de transcrição e ativação da telomerase.¹
Imortalização Celular
Um mecanismo crucial na fisiopatologia do câncer é a ativação da telomerase. Em células normais, os telômeros (extremidades dos cromossomos) encurtam-se progressivamente a cada divisão celular devido à incapacidade da DNA polimerase em replicar completamente as extremidades cromossômicas. Este encurtamento progressivo leva à perda de genes essenciais, comprometendo eventualmente as funções celulares e limitando o número de divisões possíveis. As células tumorais, entretanto, frequentemente expressam a enzima telomerase, ausente na maioria das células somáticas diferenciadas. Esta enzima adiciona sequências de DNA não codificantes às extremidades cromossômicas, prevenindo o encurtamento telomérico significativo e permitindo divisões celulares ilimitadas. A combinação de disfunções nas vias de supressão tumoral com a presença aumentada da telomerase contribui significativamente para o desenvolvimento neoplásico.¹
Progressão e Disseminação
A evolução do câncer envolve a progressiva aquisição de mutações que conferem vantagens adaptativas às células neoplásicas. A invasão de tecidos adjacentes ocorre quando o tumor cresce e se estende além de suas fronteiras originais. A penetração em vasos sanguíneos e linfáticos (invasão linfovascular) geralmente constitui o primeiro passo para a metástase.¹
Na metástase, células tumorais desprendem-se do tumor primário, degradam componentes da matriz extracelular, invadem vasos preexistentes ou induzem a formação de novos vasos (angiogênese), e disseminam-se para estabelecer focos tumorais secundários em órgãos distantes. Esta capacidade de invasão e disseminação representa a principal característica distintiva entre tumores malignos e benignos.¹
A angiogênese tumoral é estimulada pela intensa demanda metabólica das células neoplásicas em rápida proliferação, que necessitam de suprimento adicional de nutrientes e oxigênio. Além de garantir o aporte nutricional, os neovasos também fornecem uma via para disseminação metastática.¹
Conforme a Teoria da Semente e Solo, proposta por Stephen Paget em 1889, a disseminação metastática não ocorre aleatoriamente. Determinados tipos de tumores apresentam maior propensão para colonizar órgãos específicos (organotropismo), como exemplificado pela tendência do câncer de próstata em metastatizar para ossos e do melanoma uveal para o fígado. Este conhecimento facilita o monitoramento clínico e o rastreamento de metástases em locais preferenciais.¹
Metabolismo Alterado
Uma característica distintiva das células cancerosas é sua reprogramação metabólica, conhecida como Efeito Warburg. Otto Heinrich Warburg observou que células tumorais realizam preferencialmente glicólise aeróbica (fermentação lática), mesmo na presença de oxigênio suficiente para respiração mitocondrial. Esta adaptação metabólica envolve a enzima lactato desidrogenase, que converte piruvato em lactato, e confere vantagens adaptativas às células neoplásicas, incluindo rápida produção de ATP e geração de intermediários metabólicos necessários para a biossíntese de macromoléculas essenciais à intensa proliferação celular.¹
Esta complexa rede de alterações moleculares e celulares explica a heterogeneidade, adaptabilidade e agressividade que caracterizam as neoplasias malignas, representando desafios significativos para intervenções terapêuticas eficazes.
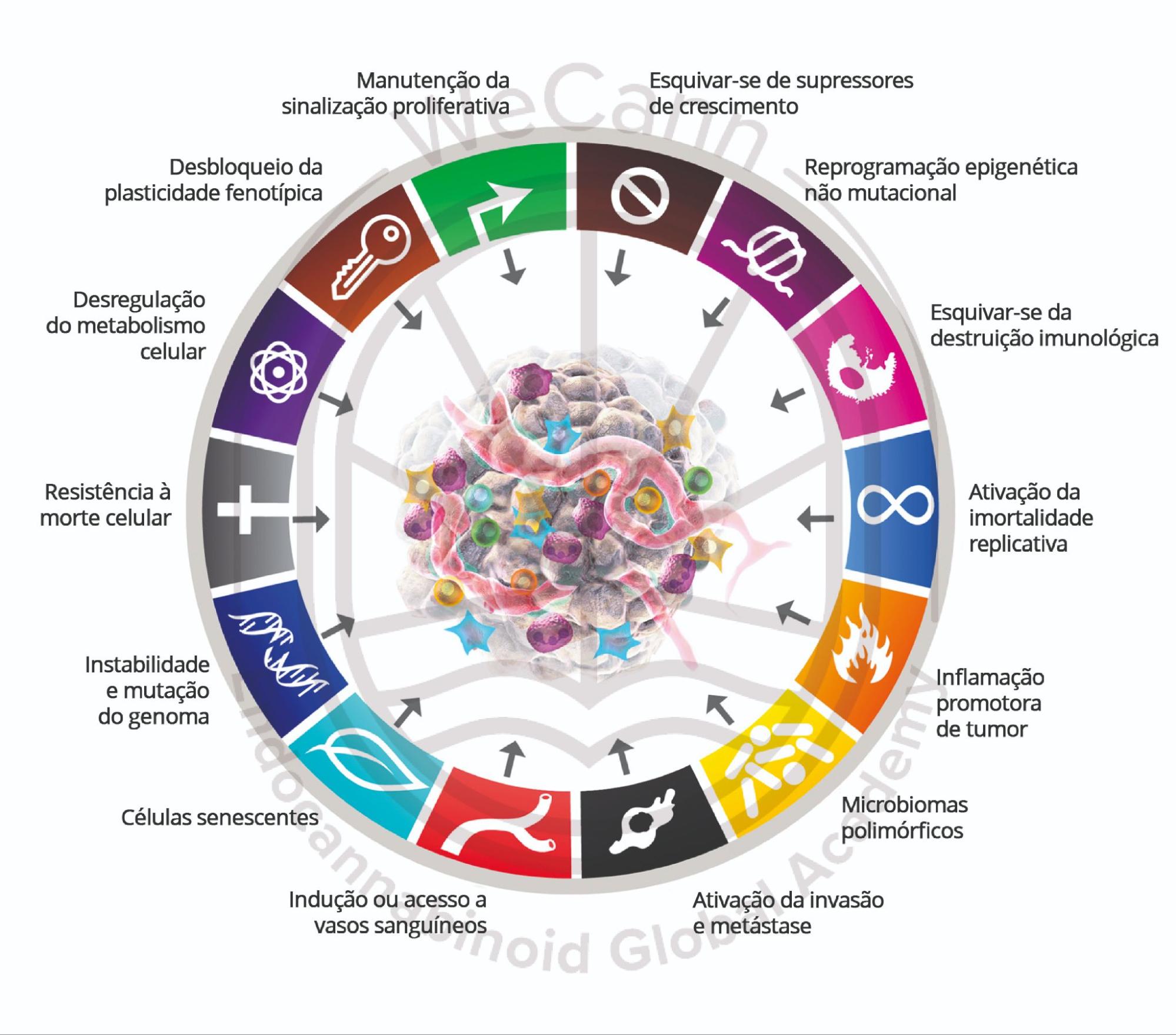
As abordagens terapêuticas convencionais para o câncer enfrentam um obstáculo fundamental: a extraordinária capacidade adaptativa das células neoplásicas. A natureza evolutiva do câncer, caracterizada pela instabilidade genômica e heterogeneidade intratumoral, permite que subpopulações celulares desenvolvam mecanismos de resistência aos tratamentos. Intervenções direcionadas a alvos moleculares específicos frequentemente apresentam eficácia temporária, seguida de escape terapêutico e progressão da doença.
Os tratamentos convencionais – cirurgia, quimioterapia e radioterapia – embora fundamentais no manejo oncológico, apresentam limitações importantes. A cirurgia oncológica, por mais precisa que seja, raramente consegue remover células tumorais disseminadas microscopicamente além das margens visíveis. A radioterapia, ainda que tecnologicamente avançada, preserva células radioresistentes capazes de repovoar o tumor. Os agentes quimioterápicos, desenvolvidos para atacar células em rápida divisão, exercem pressão seletiva que favorece a emergência de clones resistentes.
Nesse contexto, a cannabis medicinal tem demonstrado potencial na redução do crescimento de células cancerígenas. No entanto, é fundamental salientar que essa evidência se baseia predominantemente em estudos pré-clínicos. Além disso, a cannabis tem mostrado eficácia na redução de efeitos colaterais dos tratamentos oncológicos tradicionais, como a dor crônica, náuseas e perda de apetite, proporcionando uma abordagem mais abrangente no cuidado ao paciente.
Com o avanço da pesquisa e a maior compreensão dos mecanismos moleculares envolvidos, a cannabis pode se tornar uma ferramenta valiosa a ser incorporada aos tratamentos oncológicos existentes, oferecendo uma alternativa para otimizar o manejo dos sintomas e melhorar a qualidade de vida dos pacientes durante o tratamento.
Sistema Endocanabinoide e Câncer: Interfaces Moleculares
O sistema endocanabinoide (SEC) representa uma complexa rede de sinalização celular que desempenha um papel fundamental na regulação de processos fisiológicos determinantes para a homeostase tecidual. Esta rede, constituída por receptores canabinoides (principalmente CB1 e CB2), ligantes endógenos (anandamida e 2-araquidonoilglicerol), e enzimas responsáveis por sua síntese e degradação, exerce influência direta sobre mecanismos celulares intimamente associados à carcinogênese, incluindo proliferação celular, apoptose, modulação inflamatória e respostas imunológicas.²
A expressão alterada dos componentes do SEC em diversos tipos de neoplasias tem sido objeto de crescente interesse científico. Observa-se frequentemente uma superexpressão dos receptores CB1 e CB2 em tecidos tumorais quando comparados aos seus equivalentes normais. Embora esta característica possa estar correlacionada a prognósticos desfavoráveis em determinados contextos clínicos, paradoxalmente, confere maior suscetibilidade dessas células à intervenção farmacológica direcionada, estabelecendo uma janela terapêutica potencialmente explorável.²
Para saber mais sobre o Sistema Endocanabinoide acesse: O que é o Sistema Endocanabinoide?
Fisiopatologia das alterações do SEC no Microambiente Tumoral
O microambiente tumoral (TME) constitui um ecossistema celular de extrema complexidade, englobando fibroblastos associados ao câncer, células do sistema imunológico, componentes vasculares e matriz extracelular. Este ambiente dinâmico estabelece condições favoráveis à proliferação descontrolada, evasão imunológica e disseminação metastática.³
A presença ubíqua do SEC neste microambiente representa um ponto crítico de intervenção terapêutica. A literatura científica evidencia que a modulação deste sistema pode alterar significativamente as interações entre células neoplásicas e componentes estromais, potencialmente revertendo o fenótipo imunossupressor característico do TME e restabelecendo a vigilância imunológica antitumoral.³
Mecanismos moleculares dos efeitos Antineoplásicos dos Canabinoides
O Δ9-tetrahidrocanabinol (Δ9-THC), principal componente psicotrópico da Cannabis sativa, exerce efeitos antitumorais através de múltiplas vias de sinalização, predominantemente mediadas pela ativação dos receptores CB1 e CB2. Estas vias convergem para três mecanismos principais:
- Indução de estresse no retículo endoplasmático: A ativação sustentada dos receptores canabinoides pelo Δ9-THC promove acúmulo de ceramida intracelular, desencadeando estresse do retículo endoplasmático. Esta condição celular resulta na fosforilação do fator de iniciação eucariótico 2α (eIF2α) e na ativação de proteínas como CHOP (C/EBP homologous protein), culminando em interrupção do ciclo celular e ativação de vias apoptóticas intrínsecas. A consequente liberação de citocromo c mitocondrial e ativação de caspases efetoras representam etapas críticas neste processo.4
- Supressão da angiogênese tumoral: A sinalização mediada por receptores canabinoides interfere diretamente na expressão e atividade do fator de crescimento endotelial vascular (VEGF) e seus receptores. Este efeito anti-angiogênico compromete a neovascularização essencial para o crescimento tumoral além de determinados limites volumétricos, restringindo o suprimento de oxigênio e nutrientes para o parênquima neoplásico. Adicionalmente, observa-se redução na expressão de outros fatores pró-angiogênicos, como angiopoietina-2 e metaloproteinases específicas.4
- Inibição de processos metastáticos: Os canabinoides modulam negativamente a expressão de metaloproteinases de matriz (particularmente MMP-2 e MMP-9) e moléculas de adesão celular. Este efeito compromete a capacidade invasiva das células neoplásicas, dificultando a degradação da membrana basal e a migração através da matriz extracelular. Adicionalmente, a ativação dos receptores canabinoides interfere nas vias de sinalização associadas à transição epitelial-mesenquimal, processo fundamental para a aquisição de fenótipo metastático.4
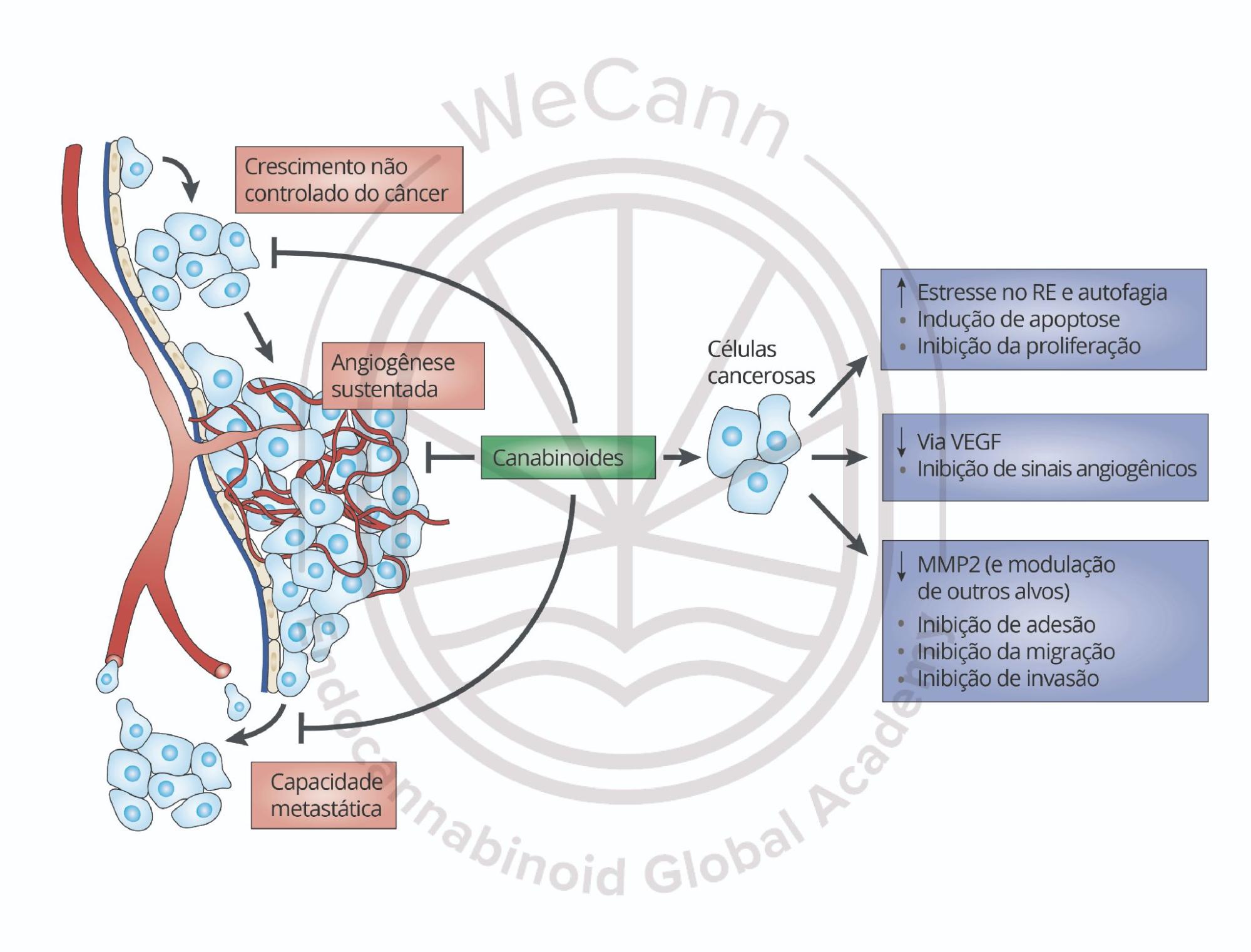
O canabidiol (CBD), fitocanabinoide não-psicotrópico, demonstra potente atividade antitumoral em estudos pré-clínicos por mecanismos distintos daqueles observados com o Δ9-THC. Sua ação ocorre predominantemente via interação com receptores alternativos, incluindo:
- Receptor GPR55: A inibição deste receptor pelo CBD interfere em vias de sinalização oncogênicas, particularmente aquelas mediadas por pequenas GTPases da família Rho, comprometendo a migração celular e induzindo morte celular programada.5
- Receptores vanilóides TRPV1: A ativação destes canais iônicos pelo CBD promove influxo de cálcio, desencadeando disfunção mitocondrial e apoptose em células tumorais.5
- Inibição da sinalização de AKT e mTOR: induz estresse no retículo endoplasmático, o que leva à inibição das vias de sinalização AKT e mTOR, essenciais para o crescimento e sobrevivência das células tumorais. O CBD também promove a apoptose (morte celular programada) ao modular a proteína beclin1 e ao reduzir o potencial da membrana mitocondrial, resultando na liberação de citocromo c e ativação da via apoptótica.6
Esta diversidade de mecanismos de ação sugere que formulações contendo múltiplos canabinoides podem exercer efeitos sinérgicos no contexto oncológico, ampliando o espectro terapêutico e potencialmente reduzindo os mecanismos de resistência tumoral.
Imunomodulação e influência no Microambiente Tumoral
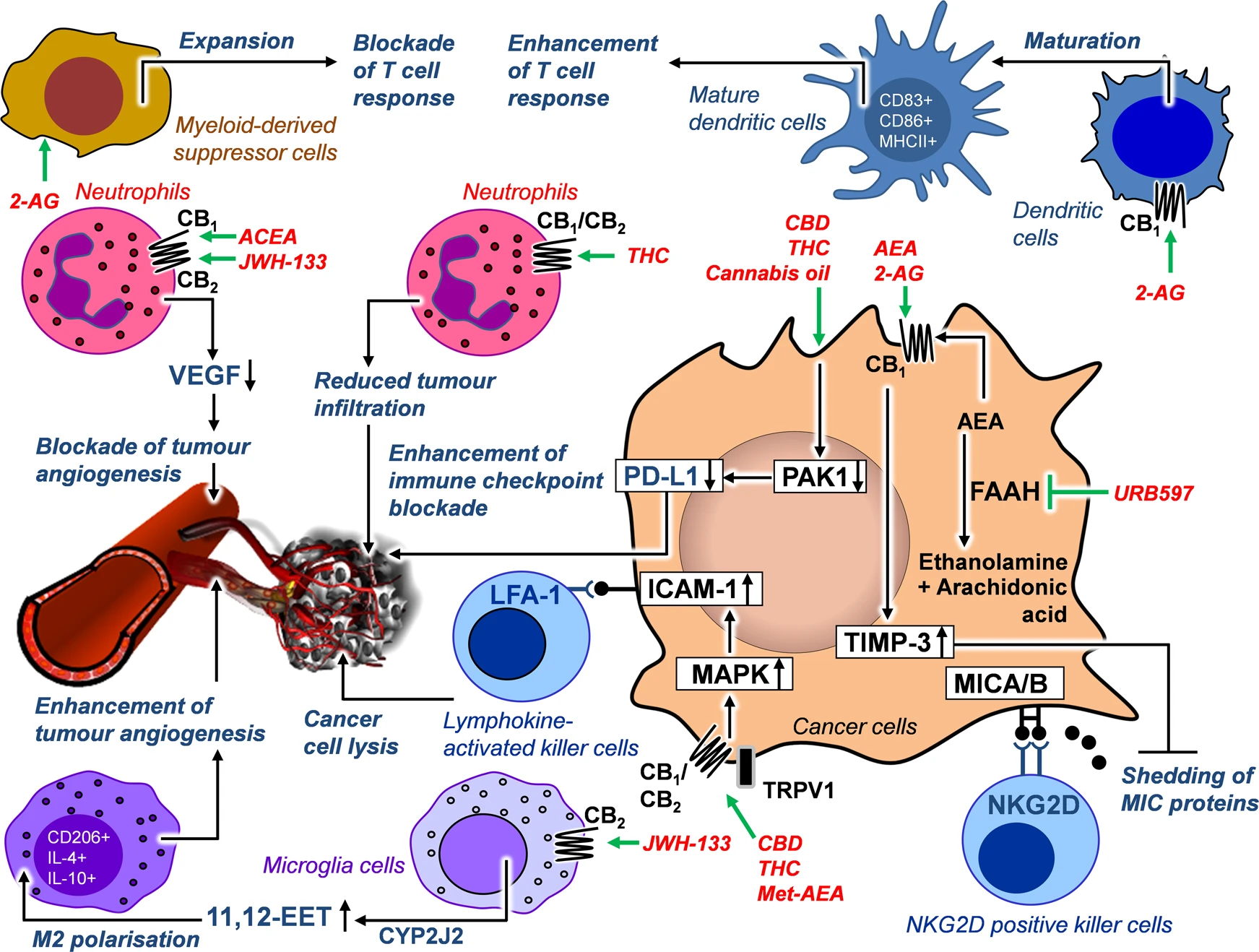
Os canabinoides exercem efeitos complexos e por vezes aparentemente contraditórios sobre o sistema imunológico no contexto oncológico:
- O THC altera significativamente o perfil de expressão gênica em subpopulações de células imunes infiltrantes do tumor, modificando o equilíbrio entre respostas Th1 e Th2. Em alguns modelos tumorais, observa-se predominância de respostas Th2, potencialmente favorecendo a progressão tumoral.7
- Em contrapartida, CBD e THC demonstram capacidade de inibir vias oncogênicas, como a via Kras, resultando em redução da expressão de PD-L1 em células de adenocarcinoma pancreático. Este efeito potencializa a eficácia de terapias baseadas no bloqueio de checkpoints imunológicos.7
- Agonistas dos receptores CB1 e CB2 inibem a produção de fatores pró-angiogênicos por neutrófilos, comprometendo a vascularização tumoral e, consequentemente, o suprimento metabólico necessário para manutenção do crescimento neoplásico.7
- O endocanabinoide 2-AG exerce efeitos duais sobre células dendríticas, promovendo um perfil pró-inflamatório favorável à resposta antitumoral. Paradoxalmente, também estimula células mielóides imunossupressoras no microambiente tumoral, embora o efeito líquido observado em diversos modelos seja de regressão tumoral.7
- A modulação do receptor CB2 pode induzir polarização de macrófagos para o fenótipo M2, tradicionalmente associado à angiogênese e progressão tumoral. Este efeito ilustra a complexidade da intervenção no SEC e a necessidade de abordagens contextualizadas conforme o tipo específico de neoplasia.7
Evidências científicas
A utilização de canabinoides como agentes terapêuticos em oncologia tem percorrido um caminho marcado por avanços significativos nas últimas décadas. O extenso corpo de evidências pré-clínicas demonstrando efeitos antitumorais destes compostos tem gradualmente incentivado a condução de estudos clínicos, inicialmente caracterizados por abordagens exploratórias e, mais recentemente, por ensaios controlados com metodologia mais robusta
O primeiro ensaio clínico formal que analisou o potencial antitumoral de um canabinoide foi conduzido por Guzmán e colaboradores em 2006, representando um marco histórico na translação das evidências pré-clínicas para o contexto clínico. Este estudo piloto de fase I envolveu nove pacientes com glioblastoma multiforme recorrente, uma neoplasia cerebral particularmente agressiva e com prognóstico notoriamente desfavorável.8
A intervenção consistiu na administração intracraniana de Δ⁹-THC diretamente no leito tumoral através de um cateter peritumoral conectado a uma bomba de infusão subcutânea. Esta via de administração foi escolhida para maximizar a concentração do composto no tecido-alvo e minimizar efeitos sistêmicos indesejados. O tratamento foi mantido por um período de 16-19 dias, com monitoramento neurológico e psicológico rigoroso.8
Os resultados demonstraram que a administração local de Δ⁹-THC foi bem tolerada, sem evidências de efeitos psicotrópicos significativos – uma preocupação relevante considerando o perfil farmacológico do composto. Análises imunoistoquímicas de amostras tumorais obtidas antes e após o tratamento revelaram um aumento na expressão de marcadores de morte celular e redução nos índices de proliferação tumoral em alguns pacientes.8
Embora promissores, os resultados deste estudo apresentaram limitações significativas. O pequeno número de participantes, a ausência de grupo controle e o curto período de acompanhamento impediram conclusões definitivas sobre a eficácia antineoplásica do tratamento. Não obstante, este estudo pioneiro estabeleceu a viabilidade e segurança da abordagem, pavimentando o caminho para investigações subsequentes.8
Com o crescente interesse clínico pelos canabinoides, diversos estudos observacionais foram conduzidos para avaliar seus efeitos em contextos oncológicos mais amplos. Neste cenário, destaca-se o trabalho de Kenyon e colaboradores, publicado em 2018, que analisou dados coletados rotineiramente de 119 pacientes com diversos tipos de câncer integrados em um programa de cannabis medicinal ao longo de quatro anos.9
Esta análise retrospectiva concentrou-se em pacientes com tumores sólidos que receberam CBD de grau farmacêutico como parte de seu tratamento. Os resultados foram notáveis: 92% dos indivíduos apresentaram respostas clínicas favoráveis, incluindo redução na carga de células tumorais circulantes (um marcador de prognóstico emergente em oncologia) e diminuição mensurável no tamanho tumoral em exames de imagem seriados.9
Particularmente interessante foi a observação de que os benefícios clínicos não se acompanharam de efeitos adversos significativos, sugerindo um perfil de segurança favorável. Análises de subgrupos indicaram que pacientes com câncer de mama, próstata e glioblastoma pareciam obter benefícios mais pronunciados, alinhando-se com dados pré-clínicos que sugeriam maior sensibilidade destes tipos tumorais aos efeitos dos canabinoides.9
Um avanço metodológico significativo ocorreu com a publicação do estudo de Twelves e colaboradores em 2021. Este ensaio clínico randomizado, duplo-cego e controlado por placebo avaliou a eficácia e segurança da adição de nabiximols (uma formulação padronizada contendo Δ⁹-THC e CBD em proporção aproximada de 1:1) ao tratamento com temozolomida em pacientes com glioblastoma multiforme em primeira recorrência.10
O desenho do estudo incluiu 27 pacientes randomizados para receber nabiximols ou placebo como spray oral, em adição à temozolomida em regime de dose intensificada. O desfecho primário foi a taxa de sobrevida em um ano, com desfechos secundários incluindo qualidade de vida, performance funcional e farmacocinética da temozolomida.10
Os resultados demonstraram uma taxa de sobrevida em um ano de 83% no grupo nabiximols, comparada a 44% no grupo placebo (p=0,042). Este benefício de sobrevida não se acompanhou de interações farmacocinéticas significativas com a temozolomida, sugerindo um perfil de segurança favorável para a combinação. Análises de qualidade de vida não evidenciaram diferenças significativas entre os grupos, embora tenha havido uma tendência não estatisticamente significativa para melhor controle de sintomas como dor e náusea no grupo nabiximols.10
A importância deste estudo reside não apenas em seus resultados positivos, mas também na qualidade metodológica superior às investigações anteriores. A randomização, o mascaramento duplo-cego e a utilização de placebo como controle minimizaram diversos vieses potenciais, fornecendo evidências mais robustas do benefício clínico da adição de canabinoides ao tratamento padrão do glioblastoma recorrente.
Expandindo o escopo da investigação clínica para além dos tumores cerebrais, Myint e colaboradores publicaram em 2023 os resultados de um estudo aberto envolvendo 21 pacientes com câncer de próstata bioquimicamente recorrente após terapia definitiva (prostatectomia radical ou radioterapia).11
O protocolo consistiu na administração de CBD oral (600-800 mg/dia) por um período de 90 dias, com monitoramento dos níveis séricos de antígeno prostático específico (PSA) como marcador de atividade da doença. Adicionalmente, avaliações da qualidade de vida, função sexual e perfil de segurança foram realizadas.11
Ao final da intervenção, 88% dos participantes mantiveram estabilidade bioquímica da doença (definida como variação nos níveis de PSA inferior a 25%), 5% apresentaram resposta parcial (redução de PSA >50%) e outros 5% evidenciaram progressão bioquímica. O perfil de segurança foi favorável, com efeitos adversos limitados a manifestações leves como diarreia, náusea e fadiga, sem necessidade de interrupção do tratamento em nenhum caso.11
Análises de biomarcadores inflamatórios séricos revelaram redução significativa nos níveis de interleucina-6 (IL-6) e fator de necrose tumoral alfa (TNF-α), sugerindo um potencial efeito imunomodulador do CBD. Esta observação é particularmente relevante considerando o papel estabelecido da inflamação crônica na progressão do câncer de próstata.11
Conclusão
As terapias convencionais contra o câncer enfrentam desafios significativos devido à alta plasticidade e resistência das células tumorais. A capacidade adaptativa das neoplasias frequentemente leva à ineficácia progressiva de intervenções como quimioterapia, radioterapia e terapias-alvo. Nesse cenário, o crescente interesse pelo sistema endocanabinoide como alvo terapêutico se justifica pelas suas múltiplas interfaces moleculares na fisiopatologia do câncer.
Estudos indicam que canabinoides, como Δ9-THC e CBD, podem modular a proliferação e a apoptose, reduzir a angiogênese tumoral e regular vias inflamatórias associadas à progressão da doença, além de oferecer alívio sintomático significativo aos pacientes oncológicos. Embora o potencial terapêutico da cannabis no câncer seja promissor, ainda há a necessidade de ensaios clínicos robustos para validar sua eficácia e elucidar melhor os mecanismos envolvidos nesses efeitos terapêuticos.
Nesse contexto, é essencial que os médicos se mantenham atualizados e busquem conhecimento em fontes confiáveis sobre novas abordagens terapêuticas para câncer, incluindo alternativas inovadoras como o uso de compostos derivados da cannabis medicinal. A WeCann, reconhecida internacionalmente como referência em educação médica, oferece informações técnicas fundamentadas em evidências científicas, auxiliando a comunidade médica na tomada de decisões responsáveis e bem embasadas. Com conteúdos de excelência, como o Tratado de Medicina Endocanabinoide, a WeCann capacita médicos ao redor do mundo a expandir seus conhecimentos e aplicar tratamentos baseados em cannabis com segurança e eficácia, promovendo uma melhor qualidade de vida para os pacientes que enfrentam essa e outras condições clínicas.
Referências
- BOARETTO, Naiara; COSTA E SILVA, Gabriel Adler; LUIZ, Fernando Augusto de Freitas; NATIVIDADE, Larissa Manes da; MASSAROTTO, Leticia Jeanne Miglioranza; SÁ, Luiz Pedro Nunes Bezerra de; CABRAL, Nathalia; AGUIAR, Cláudia Beatriz Nedel Mendes de. Câncer: uma revisão integrativa por estudantes de medicina. Boletim Científico de Medicina da UFSC, Florianópolis, v. 9, n. 2, 2023. DOI: 10.32963/bcmufsc.v9i2.6402.
- MONTAGNER, Patrícia; DE SALAS-QUIROGA, Adán. Tratado de Medicina Endocanabinoide.1. ed. WeCann Endocannabinoid Global Academy, 2023.
- Bakshi, H. A. et al. Therapeutic Potential of Cannabinoids on Tumor Microenvironment: A Molecular Switch in Neoplasia Transformation Integr: Cancer Ther. 21, 153473542210967 (2022).
- Velasco, G., Sánchez, C. & Guzmán, M. Towards the use of cannabinoids as antitumour agents. Nat. Rev. Cancer 12, 436-444 (2012).
- Mangal, N. et al. Cannabinoids in the landscape of cancer.J.Cancer Res. Clin. Oncol., 147, 2507-2534 (2021).
- Shrivastava A, Kuzontkoski PM, Groopman JE, Prasad A. Cannabidiol induces programmed cell death in breast cancer cells by coordinating the cross-talk between apoptosis and autophagy. Mol Cancer Ther. 2011 Jul;10(7):1161-72. doi: 10.1158/1535-7163.MCT-10-1100. Epub 2011 May 12. PMID: 21566064.
- Hinz, B., Ramer, R. Cannabinoids as anticancer drugs: current status of preclinical research. Br J Cancer 127, 1–13 (2022). https://doi.org/10.1038/s41416-022-01727-4
- Guzmán, M. et al. A pilot clinical study of A9. tetrahydrocannabinol in patients with recurrent glioblastoma multiforme. Br: J. Cancer-95, 197-203 (2006).
- Kenyon, J., Liu, W. & Dalgleish, A. Report of Objective Clinical Responses of Cancer Patients to Pharmaceutical-grade Synthetic Cannabidiol. Anticancer Res. 38, 5831-5835 (2018).
- Twelves, C. et al. A phase 1b randomised, placebocontrolled trial of nabiximols cannabinoid oromucosal spray with temozolomide in patients with recurrent glioblastoma Br.J.Cancer 124, 1379-1387 (2021).
- Myint, Z. W. et al. A Phase I Dose Escalation and Expansion Study of Epidiolex (Cannabidiol) in Patients with Biochemically Recurrent Prostate Cancer. Cancers 15, 2505 (2023).




