A Síndrome do X Frágil (SXF) é a causa hereditária mais comum de deficiência intelectual e uma das principais causas de autismo. É uma condição complexa que afeta o desenvolvimento cognitivo, social e comportamental, trazendo desafios significativos para os indivíduos e suas famílias.
Nos últimos anos, com o avanço da pesquisa e a crescente aceitação da cannabis medicinal, tem surgido um interesse considerável em como os compostos da planta podem interagir com o corpo para potencialmente aliviar alguns dos sintomas associados à SXF. Mas, como isso funciona? No post de hoje, vamos mergulhar nas evidências científicas para entender o potencial da cannabis medicinal na melhora dos sintomas da Síndrome do X Frágil.
Entendendo a Síndrome do X Frágil
A Síndrome do X Frágil é uma condição genética ligada ao cromossomo X. Ela é a etiologia monogênica mais prevalente de deficiência intelectual (DI) hereditária e figura como uma das principais causas genéticas do Transtorno do Espectro Autista (TEA). Sua origem reside em uma alteração no gene FMR1 (Fragile X Mental Retardation 1), localizado no cromossomo X (q27.3).¹
Patologicamente, a SXF decorre de uma expansão de repetições do trinucleotídeo CGG (>200 repetições) no promotor do gene, resultando na sua metilação e, consequentemente, na supressão da produção da proteína FMRP (Fragile X Mental Retardation Protein). A FMRP é uma proteína ligadora de RNA de criticidade fundamental para a plasticidade sináptica e o desenvolvimento neural, regulando a síntese proteica e o transporte de mRNAs em sinapses neuronais.¹
Epidemiologicamente, a prevalência da mutação completa do gene FMR1 é estimada em 1.4 por 10.000 homens e 0.9 por 10.000 mulheres, conferindo-lhe uma relevância clínica substancial. A deficiência de FMRP se manifesta em um fenótipo de amplo espectro, cuja gravidade é diretamente proporcional ao grau da mutação (e.g., mutação completa, pré-mutação, mosaicismo de metilação) e ao impacto resultante nos níveis de FMRP.¹
O quadro clínico da SXF abrange:
- Déficits Cognitivos: Variando de dificuldades de aprendizagem leves a deficiência intelectual severa.
- Comportamentos e Transtornos Neuropsiquiátricos (FXAND):
- Ansiedade: Altamente prevalente, afetando 86% dos homens e 77% das mulheres com SXF.
- TDAH: Com manifestações de hiperatividade, impulsividade e déficit de atenção.
- Transtorno do Espectro Autista (TEA): Quase um terço dos homens com SXF preenche critérios diagnósticos formais para TEA, e a vasta maioria apresenta traços autistas significativos (e.g., timidez, comportamentos estereotipados repetitivos, hiperexcitação, hipersensibilidades sensoriais).
- Comportamentos Desafiadores (BtC): Incluem autoagressão (10–81%) e agressão (12,5–60,9%), com taxas substancialmente mais elevadas que na população geral com DI.
- Problemas de Comunicação Social: Notam-se dificuldade no contato visual, timidez extrema e ansiedade em contextos sociais.
- Hipersensibilidade Sensorial: Reações exacerbadas a estímulos ambientais, como sons intensos, luzes e texturas.
- Características Físicas: Embora o foco primário não seja este, podem incluir face alongada, orelhas proeminentes e macroorquidismo em homens pós-púberes.
Em mulheres com SXF, o fenótipo é tipicamente mais atenuado, com menor incidência de DI (aproximadamente 25%) e desafios comportamentais menos severos.¹
O manejo da SXF tem sido um alvo de investigações farmacológicas contínuas. Inicialmente, estratégias como a suplementação de ácido fólico foram exploradas. Atualmente, a pesquisa avança no desenvolvimento de agentes terapêuticos que visam mitigar o transtorno do neurodesenvolvimento associado (FXAND) e, em particular, normalizar a disfunção na conectividade sináptica resultante da deficiência de FMRP, baseando-se em uma compreensão molecular aprofundada da síndrome.¹
A Síndrome do X Frágil e o Sistema Endocanabinoide
A compreensão da Síndrome do X Frágil tem avançado significativamente, e um dos pilares dessa evolução é o reconhecimento da profunda interconexão entre sua fisiopatologia e o Sistema Endocanabinoide (SEC). O SEC é considerado como um verdadeiro maestro que orquestra diversas funções vitais em nosso organismo. Essa rede complexa é tão fundamental que a encontramos em seres vivos desde os mais simples até nós, humanos, destacando seu papel central na fisiologia humana e no desenvolvimento de certas condições.
O SEC é composto por:
- Receptores Canabinoides: Primariamente os receptores acoplados à proteína G do tipo CB1 e CB2, distribuídos amplamente por quase todos os tecidos do corpo humano, embora em concentrações variadas.²
- O receptor CB1 é, sem dúvida, um dos mais abundantes receptores acoplados à proteína G no Sistema Nervoso Central (SNC), onde desempenha um papel crucial na modulação da neurotransmissão. Contudo, sua presença se estende significativamente a diversos tecidos periféricos, influenciando uma gama de processos fisiológicos.²
- Já o receptor CB2 é predominantemente expresso nas células do sistema imunológico e hematopoiético, onde exerce funções importantes na regulação da inflamação e da resposta imune. Embora em menor densidade, o CB2 também pode ser encontrado no cérebro, pâncreas e tecido ósseo, indicando sua participação em outros contextos fisiológicos e patológicos.²
- Endocanabinoides (ECs): Ligantes endógenos primários para os receptores CB1 e CB2, sendo os mais proeminentes a anandamida (AEA) e o 2-araquidonoilglicerol (2-AG). Essas moléculas lipídicas são sintetizadas e liberadas “sob demanda” a partir de fosfolipídios da membrana pós-sináptica, atuando como sinalizadores retrógrados na fenda sináptica. Ao estimularem os receptores CB1 pré-sinápticos, os ECs modulam a transmissão sináptica, atenuando a atividade neuronal subsequente através de um ciclo de feedback inibitório.²
- Enzimas: Encarregadas da síntese (e.g., fosfolipase C e diacilglicerol lipase – DAGL para 2-AG) e degradação dos ECs. A plasticidade sináptica dependente de DAGL é um mecanismo fundamental, onde o 2-AG liberado atua nos receptores CB1 pré-sinápticos para inibir a secreção de neurotransmissores excitatórios e inibitórios em todo o sistema nervoso.²
Na SXF, a redução ou ausência da FMRP não é um evento isolado, mas sim o catalisador de uma cascata de disfunções celulares que reverberam por múltiplos processos intracelulares, afetando o desenvolvimento e a dinâmica neural. Um dos mecanismos centrais nesse cenário patológico é a desregulação do SEC.³
A hipótese predominante aponta que a deficiência de FMRP altera significativamente a função da diacilglicerol lipase (DAGL), uma enzima crucial para a síntese do endocanabinoide 2-AG. Essa alteração na DAGL compromete diretamente a sinalização retrógrada de ECs nas sinapses neuronais.³
Como sabemos, os endocanabinoides atuam como mensageiros que viajam da pós-sinapse para a pré-sinapse, modulando a liberação de neurotransmissores. Quando essa sinalização retrógrada é comprometida, há um impacto direto e profundo na liberação de neurotransmissores excitatórios e inibitórios, desequilibrando a balança excitação/inibição no cérebro.³
Essa desregulação a jusante da sinalização do SEC no SNC não é apenas um fenômeno acessório; ela é um mecanismo fisiopatológico chave que contribui diretamente para as anormalidades clínicas observadas na SXF. Dentre as manifestações mais proeminentes decorrentes dessa disfunção do SEC, destacam-se:
- Hiperexcitabilidade Neuronal: O desequilíbrio na neurotransmissão leva a uma excitabilidade excessiva dos neurônios, que pode se manifestar como crises convulsivas e uma marcante hipersensibilidade sensorial a estímulos ambientais.
- Distúrbios de Ansiedade: A modulação do SEC é fundamental para a regulação do humor e da resposta ao estresse. Sua disfunção contribui para os elevados índices de ansiedade observados em indivíduos com SXF.
- Déficits Cognitivos e Comportamentais: A homeostase do SEC é essencial para processos como memória, aprendizado e controle de impulsos. Alterações nessa sinalização impactam negativamente essas funções, contribuindo para os desafios cognitivos e comportamentais característicos da síndrome, incluindo hiperatividade e comportamentos repetitivos.
Portanto, a disfunção do SEC na SXF não é um detalhe, mas um componente central que molda a apresentação clínica da síndrome. Compreender essa desregulação abre portas promissoras para intervenções terapêuticas, e é aqui que a cannabis medicinal surge como uma ferramenta de interesse crescente. Ao modular os elementos desse sistema desequilibrado, os derivados canabinoides oferecem uma nova via para tentar restaurar a homeostase e, consequentemente, mitigar os complexos sintomas da Síndrome do X Frágil.
Evidências científicas da cannabis na SXF
O CONNECT-FX representa um marco significativo na investigação de tratamentos para SXF. Este foi o maior ensaio clínico de fase 3, duplo-cego, randomizado e controlado por placebo já conduzido em crianças e adolescentes com SXF, avaliando a eficácia e segurança do ZYN002, um gel transdérmico de canabidiol.4
Embora o endpoint primário (mudança na evitação social na coorte completa de pacientes, independentemente do status de metilação do FMR1) não tenha atingido significância estatística, as análises ad hoc revelaram achados promissores. Em uma subpopulação crucial – a coorte de 169 pacientes com ≥ 90% de metilação da região promotora do gene FMR1 (condição onde o silenciamento do gene é mais provável e o impacto da SXF tipicamente mais grave) – o ZYN002 demonstrou superioridade significativa sobre o placebo.4
Nesse grupo de alta metilação, o ZYN002 (uma formulação transdérmica de canabidiol) demonstrou superioridade significativa em múltiplas análises versus placebo. Notavelmente, a subescala de Apatia Social (SA) do ABC-CFXS (Aberrant Behavior Checklist – FXS specific), uma ferramenta validada para avaliar mudanças comportamentais clinicamente significativas, atingiu o limiar de melhora substancial para os pacientes tratados com ZYN002 na semana 12.4
Além disso, as proporções de pacientes que alcançaram esse limiar de mudança significativa, tanto em Apatia Social quanto em Irritabilidade (Irr), foram estatisticamente superiores no grupo ZYN002 em comparação ao placebo. A impressão global de melhora relatada pelos cuidadores em Apatia Social, interação social e comportamentos irritáveis também foi significativamente maior com ZYN002.4
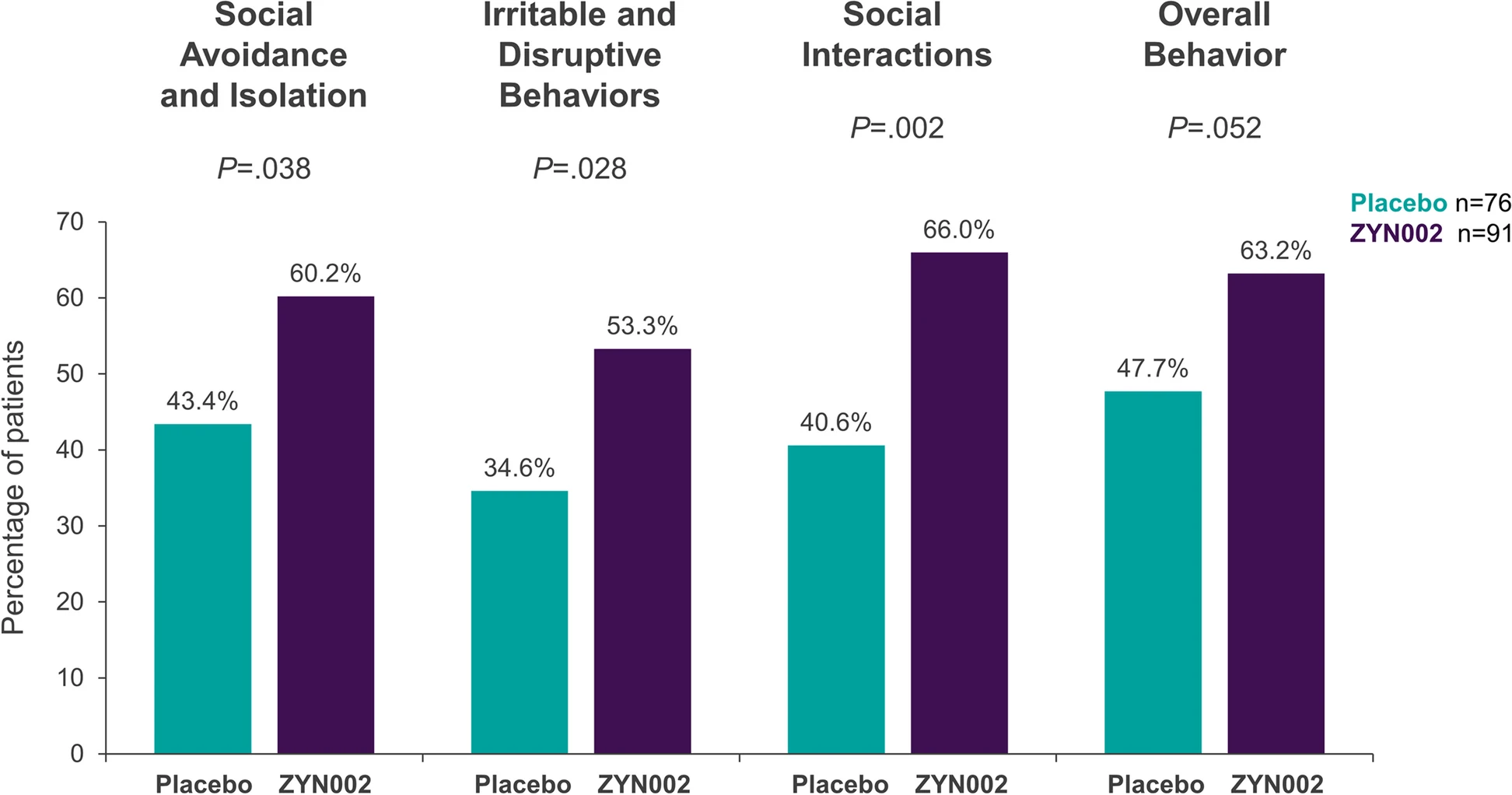
Estes resultados destacam o benefício percebido pelos cuidadores, reforçando a consistência do efeito do ZYN002 no tratamento dos sintomas comportamentais associados à SXF em pacientes com alta metilação do gene FMR1. Um estudo confirmatório de fase 3 (ZYN2-CL-033, RECONNECT; NCT04977986) está atualmente em andamento para solidificar essas descobertas.4
Quanto ao perfil de segurança, o ZYN002 foi bem tolerado. Não foram relatados eventos adversos graves (SAEs), e todos os eventos adversos emergentes do tratamento (TEAEs) foram de intensidade leve a moderada.4
É particularmente relevante que houve uma menor incidência de TEAEs psiquiátricos no grupo ZYN002 em comparação com o placebo, sugerindo que o tratamento pode ter atenuado exacerbações periódicas de sintomas tipicamente associados à SXF, como ansiedade, impulsividade, irritabilidade e estereotipias.4
Para além dos ensaios clínicos controlados, a literatura também apresenta relatos de caso e pequenas séries que corroboram o potencial terapêutico do CBD na SXF, especialmente diante da escassez de opções terapêuticas eficazes para as comorbidades como crises convulsivas, ansiedade e distúrbios do sono.
Recentemente, uma publicação detalhou três casos clínicos que exemplificam o potencial do CBD no manejo de sintomas complexos da SXF, sem a observação de eventos adversos significativos:
- Paciente Pediátrico (Caso 1): Um paciente que apresentava quadros severos de ansiedade, acessos de raiva frequentes e insônia antes do início do tratamento com CBD. Durante o primeiro mês de monoterapia com CBD, seguido por três meses de tratamento combinado com fonoterapia, terapia de linguagem e terapia ocupacional, o paciente demonstrou progressos notáveis.5
- Observou-se uma melhora significativa na alimentação e ganho de peso, melhoria na coordenação oral-motora, redução da evitação social e das sensibilidades sensoriais, além de melhorias na atenção/engajamento, na frequência e gravidade de movimentos motores atípicos e no nível geral de hiperatividade.5
- É crucial destacar a regressão dos sintomas pré-tratamento após a descontinuação do CBD e a subsequente melhora ao reiniciar a terapia, sugerindo uma clara relação temporal entre o uso do CBD e a mitigação dos sintomas. Esse progresso, especialmente na manutenção de escores de funcionamento adaptativo em uma idade em que tipicamente se observa declínio em meninos com SXF, ressalta o impacto positivo potencial do CBD.5
- Paciente Adulto Masculino (Caso 2): Este paciente apresentou uma resposta igualmente encorajadora ao tratamento com solução de CBD. Em apenas uma semana, foram notadas redução da ansiedade, melhor uso da linguagem e melhora significativa do padrão de sono. O acompanhamento de longo prazo confirmou a sustentabilidade desses benefícios com o uso contínuo do CBD.5
- Paciente Adulto Feminino (Caso 3): Uma mulher com SXF e alto funcionamento, que convivia com sintomas de ansiedade crônica, também demonstrou um efeito positivo com o uso da solução de CBD. De forma similar ao primeiro caso, a interrupção do tratamento foi associada à recorrência dos sintomas de ansiedade, enquanto o reinício do CBD resultou em nova melhora e uso a longo prazo com benefício sustentado.5
Para saber mais sobre como os canabinoide atuam na ansiedade acesse: O papel dos canabinoides no tratamento da ansiedade
Esses achados, alinhados com dados pré-clínicos, reforçam o potencial do CBD como uma intervenção terapêutica multifacetada para indivíduos com SXF. O CBD não apenas impacta o sistema endocanabinoide, mas também interage com receptores como o 5HT1A (serotonina) e atua como um modulador alostérico positivo nos receptores GABA. Essa ação pleiotrópica confere ao CBD a capacidade de abordar múltiplas vias fisiopatológicas na SXF, distinguindo-o de agentes que visam um único sistema.
A pesquisa pré-clínica em modelos animais de SXF complementa os achados clínicos, fornecendo insights sobre os mecanismos de ação. O canabidivarina (CBDV), um análogo do CBD, tem sido investigado no modelo de camundongo Fmr1-KO (nocaute do gene Fmr1).6
- Impacto no Neurodesenvolvimento: Um estudo demonstrou que a administração crônica de CBDV a partir do desmame (PND 21) foi mais eficaz do que a administração subcrônica na idade adulta. O tratamento crônico desde a fase juvenil preveniu ou eliminou quase todos os fenótipos comportamentais semelhantes à SXF nesses camundongos mutantes, exceto a hiperatividade.6
- Isso incluiu a normalização de comportamentos sociais reduzidos, falta de preferência pela novidade social, hipersensibilidade sensorial ao sobressalto acústico e déficits de memória de objetos. Essa observação reforça a hipótese de que a intervenção precoce pode ser crucial para otimizar os resultados terapêuticos.6
- Modulação de Marcadores Cerebrais: Embora com variabilidade, o CBDV também demonstrou afetar a expressão de marcadores inflamatórios e de plasticidade cerebral em camundongos WT e Fmr1-KO, particularmente com a administração crônica. Esses achados sugerem que, além da modulação direta do SEC, o CBDV pode exercer efeitos neuroprotetores e anti-inflamatórios que contribuem para seus benefícios.6
- Restauração do Tônus Endocanabinoide: Acredita-se que a perda da FMRP na SXF interrompa a sinalização do SEC. O CBDV, assim como o CBD, provavelmente atua resgatando esse tônus endocanabinoide alterado, por exemplo, normalizando a atividade de enzimas que degradam os endocanabinoides, como a FAAH (amida hidrolase de ácidos graxos) e a MAGL (lipase monoacilglicerol).6
Conclusão
A complexa relação entre a fisiopatologia da Síndrome do X Frágil e a desregulação do sistema endocanabinoide oferece um sólido racional biológico para a investigação e o uso da cannabis medicinal. Os fitocanabinoides, como o CBD e o CBDV, demonstraram em estudos pré-clínicos e em ensaios clínicos iniciais, a capacidade de modular a hiperexcitabilidade neuronal, a plasticidade sináptica e os comportamentos desafiadores que caracterizam a SXF.
Os relatos de caso, embora anedóticos, fornecem um vislumbre das melhorias clínicas percebidas por pacientes e cuidadores em sintomas como ansiedade, distúrbios do sono e habilidades de comunicação, reforçando o potencial terapêutico dessas substâncias.
Contudo, é importante reconhecer que, apesar dos resultados promissores, a maioria das evidências em humanos ainda provém de estudos de fase inicial ou relatos observacionais. A necessidade de ensaios clínicos randomizados, controlados e de maior porte é fundamental para consolidar a eficácia e a segurança da cannabis medicinal na SXF.
Nesse cenário, o papel do médico é insubstituível. É importante que nos mantenhamos continuamente atualizados acerca das novas descobertas científicas e das evidências clínicas emergentes. A prescrição de cannabis medicinal na SXF, como em qualquer condição de saúde complexa, deve ser fundamentada em uma análise crítica da literatura, uma avaliação individualizada do paciente — considerando seu perfil clínico, comorbidades e medicações concomitantes –, e um monitoramento rigoroso dos benefícios e possíveis eventos adversos.
Ao assumir uma postura proativa e baseada no conhecimento científico, asseguramos a entrega do mais elevado padrão de cuidado aos nossos pacientes com Síndrome do X Frágil. Este posicionamento nos permite navegar com segurança e ética em um campo terapêutico que promete inovações significativas e um impacto positivo substancial na qualidade de vida desses pacientes.
ELEVE SUA PRÁTICA CLÍNICA A UM NOVO PATAMAR
Após aprender sobre o potencial terapêutico da cannabis na melhora dos sintomas da Síndrome do X Frágil, dê o próximo passo na sua jornada profissional com o WeCann Summit 2025 – o mais importante evento internacional dedicado à medicina endocanabinoide e inovações terapêuticas na saúde.
O WeCann Summit 2025, que acontecerá nos dias 23, 24 e 25 de outubro no Royal Palm Hall, em Campinas, representa uma oportunidade única para aprofundar seu conhecimento sobre o sistema endocanabinoide, suas aplicações clínicas em diversas condições, e novas e promissoras fronteiras da Medicina, como sistemas de suporte à decisão clínica baseados em Inteligência Artificial.
Este evento reúne experts de quatro continentes, oferecendo:
- Conteúdo técnico altamente qualificado;
- Protocolos práticos para implementação imediata em seu consultório;
- Rede de contatos com especialistas e colegas de +50 especialidades e áreas de atuação.
O WeCann Summit 2025 é mais do que um congresso médico: é o ponto de encontro entre ciência, inovação e prática médica de excelência.
Seu passaporte para novas fronteiras da Medicina está disponível apertando no botão abaixo:
Referências
- Watkins LV, et al. Pharmacological management of fragile X syndrome: a systematic review and narrative summary of the current evidence. Expert Opin Pharmacother. 2024; 25:301-313. doi: 10.1080/14656566.2024.2323605
- tratado
- Berry-Kravis E, et al. A randomized, controlled trial of ZYN002 cannabidiol transdermal gel in children and adolescents with fragile X syndrome (CONNECT-FX). J Neurodev Disord. 2022; 14:56. doi: 10.1186/s11689-022-09466-6
- Berry-Kravis E, et al. A randomized, controlled trial of ZYN002 cannabidiol transdermal gel in children and adolescents with fragile X syndrome (CONNECT-FX). J Neurodev Disord. 2022; 14:56. doi: 10.1186/s11689-022-09466-6
- Tartaglia N, et al. Treatment of Fragile X Syndrome with Cannabidiol: A Case Series Study and Brief Review of the Literature. Cannabis Cannabinoid Res. 2019; 4:3-9. doi: 10.1089/can.2018.0053
- Premoli M, et al. Early Administration of the Phytocannabinoid Cannabidivarin Prevents the Neurobehavioral Abnormalities Associated with the Fmr1-KO Mouse Model of Fragile X Syndrome. Cells. 2023; 12:(unknown pages). doi: 10.3390/cells12151927





